方法概述
終態分析法是利用逆向思維方式,以與待求量相關的物質(離子、分子或原子)在變化終態的存在形式為解題的切入點,找出已知量與待求量之間的關係,不考慮中間變化過程的一種快捷有效的解題方法。在一些多步反應或多種混合物的計算中,由於涉及到反應繁多、數據不一或變化過程複雜,解題時如果逐一去分析這些反應或過程,按步就班的進行計算,往往會糾纏不清,導致思維混亂,不但費時費力,而且極易出錯,甚至無法解答。但如果我們淡化中間過程,關注最終組成,利用守恆關係進行整體分析,就會簡化思維,從而快速求解 。
分析反應產物,利用元素守恆求解
實例1
向一定量Fe、FeO的混合物中加入250mL2mol·L的HNO溶液,反應完成後生成1.12LNO(標準狀況),再向反應後溶液中加入1mol·LNaOH溶液,要使鐵元素完全沉澱下來,所加入NaOH溶液的體積最少是( )
A、450mL B、500mL C、400ml D、不能確定
分析:此題涉及多個反應,若全部寫出化學方程式來計算顯得十分繁瑣,要使鐵元素完全沉澱,但不能確定鐵元素最終以Fe(OH)或Fe(OH)出現,HNO是否過量也不能確定,因而順向求解比較困難。若忽略中間反應過程,運用終態尋求守恆關係,即可迅速求解。
解答:要使鐵元素恰好完全沉澱,最後溶液必為NaNO溶液,由原子守恆有n(NaOH)=n(NO)=n(HNO)-n(NO),即0.25L×2mol·L-(1.12L/22.4L·mol ) =V(NaOH)×1mol·L,所以V(NaOH)=0.45L=450mL。答案為A。
實例2
有一在空氣中暴露過的KOH固體,經分析知其含水2.8%,含KCO37.3%,其餘為KOH。現取1g樣品加入到25mL2mol·L的鹽酸中,多餘鹽酸用1.0mol·LKOH溶液33.9mL恰好完全中和,蒸發中和後溶液可得到固體( )
A、1g B、 3.725g C、 0.797g D、2.836g
分析:將樣品加入到鹽酸中發生反應①KCO+2HCl=2KCl+CO↑+HO、②KOH+HCl=KCl+HO,反應後鹽酸剩餘,加入KOH又發生反應②。該題雖涉及反應不多,但數據較多,用常規方法很難解答。運用終態法分析:
思路1:始態KCO、KOH,終態KCl,利用K守恆求解;
思路2:始態HCl,終態KCl,利用Cl守恆求解。
在思路1中要注意K有2個來源:一是樣品中,二是後來加入的KOH (容易忽略),這種方法涉及到多步計算,既有物質的量的運算又有質量的運算,比較繁且易出錯。因此採用思路2中的Cl守恆一步到位,比較簡單。
解答:據題意反應結束後溶質只有KCl可知:
n(KCl)=n(Cl)=n(HCl)=0.025L×2mol·L=0.05mol
m(KCl)=0.05mol×74.5g·mol=3.725g。答案為B。
實例3
把 a g鐵鋁合金粉末溶於足量鹽酸中,加入過量NaOH溶液。過濾出沉澱,經洗滌、乾燥、灼燒得到紅棕色粉末的質量仍為 a g,則原合金中鐵的質量分數為( )
A.70% B.52.4% C.47.6% D.30%
分析:把鐵鋁合金粉末溶於足量鹽酸中,生成了Al和Fe,再加入過量NaOH溶液,Al轉化為AlO留在溶液中;Fe生成Fe(OH)沉澱。過濾後對沉澱進行灼燒得到紅棕色粉末為被氧化和分解生成的FeO。在此過程中涉及反應多且無具體數據,按常規方法計算容易出錯。
解答:根據始態合金與終態FeO的質量相等,而鐵在整個反應過程中守恆,所以合金中鋁的量等於FeO中氧的量,即w(Fe)=112/160×100%=70%,選A 。
根據氧化還原反應中電子守恆求解
例5:足量銅與一定量濃硝酸反應得到硝酸銅溶液和NO、NO、NO 的混合氣體,這些氣體與1.68LO(標準狀況)混合後通入水中,所有氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入5mol·LNaOH溶液至Cu恰好完全沉澱,則消耗NaOH溶液的體積是( )
A.60mL B.45mL C.30mL D.15mL
分析:根據題意可將題中的反應過程表示如下:
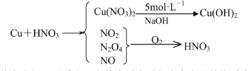 終態法
終態法從中我們可以看出:在整個反應過程中失電子的物質為Cu,而得電子的物質為O,HNO中的N元素在整個過程中最終沒有變價(即反應前與反應後的價態相同)。因此利用氧化還原反應中得失電子守恆規律得出:
n(Cu)×2=n(O)×4,n(Cu)=2n(O)==0.15mol。
然後加氫氧化鈉溶液時發生Cu+2OH=Cu(OH)↓,所以n(OH)=2n(Cu),因此V(NaOH)==0.06L=60mL。
總結
終態分析法是一種整體思維方法,可以概括為“抓住反應本質,巧妙跨越中態,藉助守恆關係,利用終態列式”。因只考慮起始和終態,從而可大大簡化解題過程,提高解題效率。

