簡介
 外軌配合物和內軌配合物
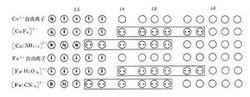
外軌配合物和內軌配合物根據L.C.鮑林的價鍵理論,具有八面體結構並有4個未成對電子的、順磁性的【CoF】,或有5個未成對電子的、順磁性的【Fe(HO)】,其配位成鍵雜化軌道為4s4p4d,所用d 軌道與s和p軌道是屬於同一主能級的。這類具有spd形式的配合物(見配位化合物), 因為使用了外層的d軌道,所以叫做外軌配合物。兩種配合物的雜化成鍵軌道分別如圖所示。
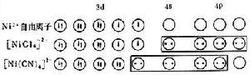
對於具有八面體結構且所有電子都是成對的、抗磁性的【Co(NH)】, 或具有1個未成對電子的、 順磁性的【Fe(CN)】,其成鍵雜化軌道為3d4s4p,使用了比s和p軌道低一級主能級層中的d軌道。這類具有(-1)dsp型式的配合物,由於使用了內層的d軌道,所以叫做內軌配合物。在四配位體系中,具有四面體結構且有兩個未成對電子的順磁性的【NiCl】,其成鍵雜化軌道為4s4p,屬外軌配合物。而所有電子都成對的、抗磁性的【Ni(CN)】,其成鍵雜化軌道為3d4s4p,是平面正方形結構,屬內軌配合物。
定義
根據中心原子雜化時所提供的空軌道所屬電子層的不同,配合物可分為兩種類型,即外軌配合物和內軌配合物。
 外軌配合物和內軌配合物
外軌配合物和內軌配合物若中心原子全部用最外層價電子的空軌道(ns、np、nd) 雜化成鍵,所形成的配鍵稱外軌配鍵,對應的配合物稱外軌配合物;另一種是中心原子用了次外層d 軌道,即(n - 1)d和最外層的ns,np 軌道進行雜化成鍵,所形成的配鍵稱內軌配鍵,對應的配合物稱為內軌配合物。如中心原子採取sp、sp3、sp3d2雜化軌道成鍵,形成配位數為2、4、6的配合物都是外軌配合物,中心原子採取dsp2或 d2sp3雜化軌道成鍵形成配位數為4 或 6 的配合物都是內軌配合物。
影響因素
配合物是內軌型還是外軌型,主要取決於中心離子的電子構型、離子所帶的電荷和配位原子的電負性大小。
具有(n - 1)d10構型的離子,只能用外層軌道形成外軌型配合物;具有(n - 1)d8構型的離子如在大多數情況下形成內軌塑配合物;具有(n-1 )d4-d7構型的離子,既可形成內軌型,也可形成外軌型配合物;具有(n - 1) d1-3構型的離子,一般形成內軌配合物。這類配合物往往含有空的(n - 1)d軌道,而含有空(n - 1)d軌道的內軌配合物大多不穩定。
中心離子的電荷增多有利於形成內軌型配合物。因為中心離子的電荷較多時,它對配位原子的孤電子對引力增強,利 於以其層 d 軌道參與成鍵。電負性大的原子如F、O等 ,與電負性較小的C 原子比較,通常不易提供孤電子對,它們作為配位原子時,中心離子以外層軌道與之成鍵,因而形成外軌型配合物。C原子作為配位原子時 則常形成內軌型配合物 。
內軌型配合物和外軌型配合物,其穩定性是不同的,一般內軌型配合物比外軌型配合物穩定。
配合物簡介
為一類具有特徵化學結構的化合物,由中心原子(或離子,統稱中心原子)和圍繞它的分子或離子(稱為配位體/配體)完全或部分通過配位鍵結合而形成。
包含由中心原子或離子與幾個配體分子或離子以配位鍵相結合而形成的複雜分子或離子,通常稱為配位單元。凡是含有配位單元的化合物都稱作配位化合物。研究配合物的化學分支稱為配位化學。
配合物是化合物中較大的一個子類別,廣泛套用於日常生活、工業生產及生命科學中,近些年來的發展尤其迅速。它不僅與無機化合物、有機金屬化合物相關連,並且與現今化學前沿的原子簇化學、配位催化及分子生物學都有很大的重疊。
顯然含有配位鍵的化合物就不一定是配位化合物,如硫酸及銨鹽等化合物中儘管有配位鍵,但由於沒有過渡金屬的原子或離子,故它們也就不是配位化合物。當然含有過渡金屬離子的化合物也不一定是配位化合物,如氯化鐵、硫酸鋅等化合物就不是配位化合物。