八面體構型配合物的幾何異構
組成相同而結構不同的分子或者複雜離子叫做異構,八面體配合物的幾何異構現象比較普遍,對於[MAX]型配合物,比如典型的二氯 四氨合鉻(III)離子,反式構型的配體為綠色,而順式構型為紫色:
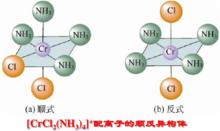 圖一
圖一 又如[CrBr(NH)]配離子的面式和經式異構:
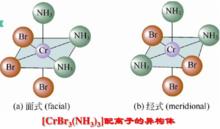 圖二
圖二 外軌型八面體配合物和內軌型八面體配合物
八面體配合物的中心離子d軌道的電子數為4-7時,形成配合物時有兩種情況,一種是外層d軌道參與雜化,形成所謂的外軌型配合物;另一種是內層d軌道參與雜化,形成所謂的內軌型配合物。外軌型配合物和內軌型配合物都是正八面體結構 。
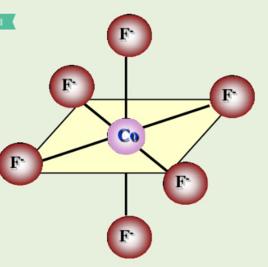
例如Co 離子:
 八面體構型配合物
八面體構型配合物 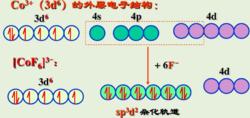 圖三
圖三 如圖三所示,[CoF] 配離子的中心離子外層的4d軌道參與雜化,採用的是sp3d2雜化,而3d軌道未參與雜化,3d軌道上電子未重排,有4個未成對電子,為外軌型高自旋配合物。
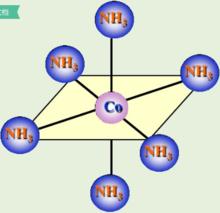 八面體構型配合物
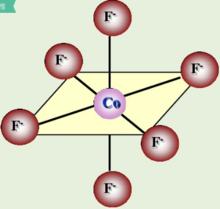
八面體構型配合物 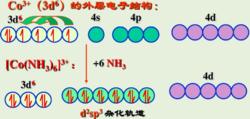 圖四
圖四 如圖四所示,[Co(NH)] 配離子的中心離子內層3d軌道上電子發生重排,沒有成單電子,空出兩個空的3d軌道參與重排,採用的是d2sp3雜化,為內軌型低自旋配合物。
另一個離子是Fe 離子,如圖五所示:
 圖五
圖五 產生上述情況的原因與配體場的強弱有關,當配體場較強時,它可以影響中心離子的d電子,使中心離子的單電子發生配對,讓出空軌道,空軌道與4s、4p軌道發生d2sp3雜化,形成內軌型的雜化軌道,這樣形成的配合物比較穩定;當配體場較弱時,它不能影響中心離子的d軌道,只能採用sp3d2雜化形成外軌型配合物,這樣形成的配合物穩定性較差。