概念
 四羥基合鋁酸根
四羥基合鋁酸根人教版教材中編寫道:氫氧化鋁溶於氫氧化鈉溶液生成偏鋁酸鈉溶液,而後來的山東科學技術出版社出版的化學教材(必修一)中,講到鋁和其金屬材料一課中,說Al和NaOH和水反應生成Na[Al(OH)₄]四羥基合鋁酸鈉。實際上,偏鋁酸鈉在水溶液中都是以Na[Al(OH)₄]的形式存在,以前只不過是為了方便,把它簡寫成NaAlO₂。但它的實際組成還是Na[Al(OH)₄]。
相關公式
2Al+2NaOH+6H₂O=2Na[Al(OH)₄]+3H₂↑(註:Na[Al(OH)₄]:四羥基合鋁酸鈉)
也就是說,其實在溶液中不存在AlO₂¯(註:HAlO₂為偏鋁酸),只存在[Al(OH)₄]¯
相關化學式:2Al+2NaOH+6H₂O=2Na[Al(OH)₄]+3H₂↑(註:Na[Al(OH)₄:四羥基合鋁酸鈉)
氫氧化鈉和Al(OH)₃反應 : NaOH+Al(OH)₃=Na[Al(OH)₄]
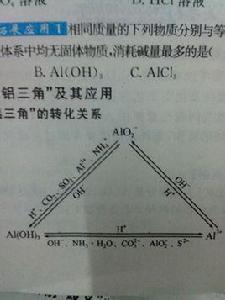
偏鋁酸鈉有關化學方程式: 2NaAlO₂+CO₂(少量)+3H₂O=2Al(OH)₃↓+Na₂CO₃( 強酸制弱酸)
NaAlO₂+CO₂(過量)+2H₂O=Al(OH)₃↓+NaHCO₃
NaAlO₂+HCl(少量)+ H₂O =Al(OH)₃↓+NaCl
NaAlO₂+4HCl(過量)=AlCl₃+NaCl +2H₂O
NaAlO₂+NaHCO₃+H₂O=Al(OH)₃↓+Na2CO₃
3NaAlO₂+AlCl₃+6H2O=4Al(OH)₃↓+3NaCl