基本內容
1.了解原電池的組成
組成原電池有三個不可缺少的條件,這三個條件是:
(1)電極 由兩塊活潑性能不同的金屬作為原電池的兩個電極。活潑的金屬是電池的負極,不活潑金屬(或非金屬導體)是電池的正極。
 原電池反應
原電池反應(2)電解質溶液 根據電解材料,可以選擇酸、鹼、鹽溶液作為組成的電解質溶液。
(3)導線 用以連線兩極,才能使浸入電解質溶液的兩極形成閉合迴路,組成正在工作的原電池。
2.理解原電池的工作原理
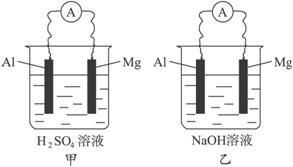
當把鋅板和銅板平行放入盛有稀硫酸的燒杯里,用連有電流計的導線連線兩極時,可以觀察到三個重要的現象:鋅片溶解,銅片上有氣體逸出,導線中有電流通過。
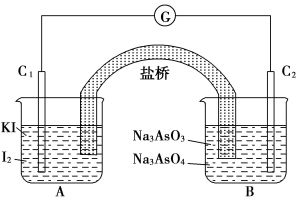
此外,在食鹽溶液加快生鏽的過程中,也發生了原電池反應
透過這些現象,分析兩極反應的實質,便可理解原電池是怎樣把化學能轉變為電能的原理。鋅是活潑金屬,容易失去電子變為進入溶液,鋅電極發生的電極反應式是:
鋅片 Zn-2e-=Zn2+ (氧化反應)
鋅失去的電子沿導線經電流計流入銅片,溶液里的在銅電極上得到電子變為氫原子,進而結合為氫分子,銅電極發生的電極反應式是:
銅片 2H+2e-=H2↑ (還原反應)
由於在鋅、銅兩個電極上不斷發生的氧化還原反應,使化學能轉變為電能。鋅片是給出電子的一極,是電池的負極,銅片是電子流入的一極,是電池的正極。電流的方向同電子流的方向相反,從正極銅流向負極鋅。
在原電池內電解質溶液中,陰離子流向負極,陽離子流向正極