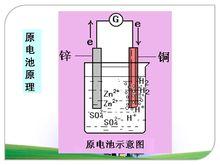
原理
氫原子結合成氫分子從銅片上放出。兩極發生如下反應:
正極:2H +2e =H↑(稀硫酸溶液為電解質溶液)
負極:Zn-2e =Zn
總反應式:Zn+2H =Zn +H↑
方法一
實驗儀器及用品
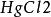 銅鋅原電池
銅鋅原電池試管,鑷子,銅棒,,0.1mol·L 硫酸溶液
操作
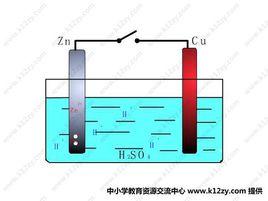
取一試管並斜放入一大粒純鋅(如沒有純鋅可將粗鋅泡在飽和的氯化汞溶液中,用鑷子夾出沖洗淨),再倒入0.1mol·L 硫酸溶液,觀察表面逸出氣泡情況。
 鋅銅原電池
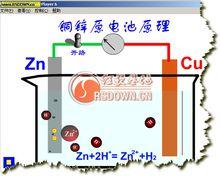
鋅銅原電池在盛有純鋅和0.1mol·L 硫酸溶液中,用一根純銅棒插在純鋅的表面上,可以觀察到在鋅表面氣泡很少,而在插進液面中銅棒四周氣泡很多。(如圖)
結論
銅表面氣泡來源不可能是銅與稀硫酸反應,而是鋅丟失的電子同遇到溶液中的氫離子發生了反應。可以推知鋅流出電子,在流經銅導線時,將電子轉移給銅四周的氫離子。
方法二
實驗儀器及用品
燒杯、鋅板、銅板、電流計、導線、0.1mol·L-1硫酸溶液
操作
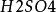 銅鋅原電池
銅鋅原電池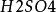 銅鋅原電池
銅鋅原電池用一個燒杯、盛入0.1mol·L 的溶液後,用固定鋅、銅兩電極的插座,把鋅和銅兩個電極浸泡在0.1mol·L 中,再用電流計和導線把兩級連線好。
現象
除銅極有氫逸出外,在電流計中還可以看到指針發生偏轉,表示有電流產生。
 銅鋅原電池
銅鋅原電池注意
1.如果接通後,導線串連的電流計指針不發生偏轉,或是瞬息偏轉,都是失敗的現象。在溶液與電極接觸處如銅極無氣體產生時,這也是失敗的現象。
2.純鋅片若不好找到,可將粗鋅置飽和氯化汞溶液中浸泡,用鑷子取出,再經沖洗後可以使用。防止用手接觸溶液,實驗後一定要用肥皂洗手。
方法三
實驗儀器及用品
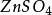 銅鋅原電池
銅鋅原電池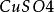 銅鋅原電池
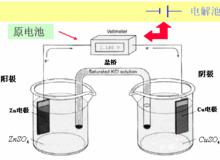
銅鋅原電池燒杯,KCl鹽橋,1mol·L 溶液,1mol·L-1 溶液,鋅極板,銅極板,電流計,導線
操作
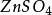 銅鋅原電池
銅鋅原電池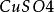 銅鋅原電池
銅鋅原電池如圖,在兩燒杯中分別盛有(1)1mol·L 溶液和(2)1mol·L 溶液,(3)為瓊脂和飽和氯化鉀溶液的鹽橋。操作和現象同之二所述。
 銅鋅原電池
銅鋅原電池注意
1.銅片面積大一些,便於觀察。鋅片純一些,可以減少鋅片上的氣泡。
2.電流計可以用發光二極體或導電儀代替用發光來檢測電流通過。
形成條件
活動性不同的兩個金屬(或其中一種為非金屬,即作導體作用)作電極
電極均插入電解質溶液
必須有閉合的迴路
1.活動性不同的兩個金屬(或其中一種為非金屬,即作導體作用)作電極
2.電極均插入電解質溶液
3.必須有閉合的迴路
反應本質
氧化還原反應
判斷方法
微觀判斷:
①根據電子流動方向
電子流出的極——負極
電子流入的極——正極
巨觀判斷:
②根據電極材料
較活潑的電極材料——負極
較不活潑的電極材料——正極
③根據原電池電極發生的反應
發生氧化反應的極——負極
發生還原反應的極——正極
組成
| 組成 | 負極 | 正極 | 電解質液 |
| 電極材料 | 能導電的物質 | 酸溶液 鹼溶液 鹽溶液 熔融液 | |
| 電極上發生反應的物質 | 還原性較強的物質(多是金屬電極本身) | 氧化性較強的物質 | |
| 電子流向 | 流出電子 | 流入電子 | |
| 反應類型 | 氧化反應 | 還原反應 | |