警示語
與痴呆有關的老年精神病患者死亡率增加
與痴呆有關的老年精神病患者服用非典型抗精神病藥物後死亡率有增加的風險。在此類患者完成的17個安慰劑對照試驗(眾數療程約為10周)中,非典型抗精神病藥物導致死亡的風險是安慰劑的1.6-1.7倍;在為期10周的對照試驗中,藥物治療患者的死亡率約為4.5%,安慰劑約為2.6%。儘管死亡原因各不相同,主要的致死原因包括心血管疾病(如,心衰和猝死)和感染(如,肺炎)。齊拉西酮未批准用於治療痴呆相關的精神病。
成份
 卓樂定
卓樂定本品主要成份為:鹽酸齊拉西酮。
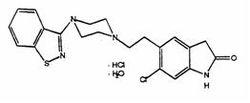
化學名稱:5-[2-[4-(1,2-苯並異噻唑-3-基)-1-哌嗪基]乙基]-6-氯-1,3-二氫-2(1H)-吲哚-2-酮鹽酸鹽一水合物。
化學結構式:
分子式:CHClNOS·HCl·HO
分子量:467.42
性狀
本品為硬膠囊,內容物為類白色至微粉色粉末。
適應症
本品適用於治療精神分裂症。
規格
⑴20mg;⑵40mg;⑶60mg;⑷80mg(按齊拉西酮計)
用法用量
初始治療:一次20mg,一日二次,餐時口服。視病情可逐漸增加到一次80mg、一日二次。為了確保最低有效劑量,在調整劑量前應仔細觀察患者用藥後的反應。劑量調整間隔一般應不少於2天,因為口服本品在1-3天內血藥濃度達到穩定狀態。
維持治療:應定期評估並確定患者是否需維持治療。儘管齊拉西酮維持治療的時間長短尚未確定,但在52周臨床試驗中,精神分裂症患者持續使用齊拉西酮的有效劑量為:一次20-80mg,一日二次。在維持治療期間,應採用最低有效劑量,多數情況下,使用20mg齊拉西酮每日兩次即足夠。
特殊人群用藥:不同年齡、性別、種族人群,以及腎功能或者肝功能損傷的患者,一般均無需調整劑量。
不良反應
 卓樂定
卓樂定 卓樂定
卓樂定國外上市前臨床試驗報導了以下不良反應:
精神分裂症患者:齊拉西酮組和安慰劑組不良反應所致停藥率分別為4.1%(29/702)和2.2%(6/273)。主要不良反應為皮疹,齊拉西酮組有7例患者因皮疹停藥(1%),安慰劑組為0。短期安慰劑對照試驗中,發生率大於5%的常見不良反應見表1。
表2 列出了精神分裂症患者在急性期治療(最長6周)時,不良反應的發生率,包括發生率超過2%的接受齊拉西酮治療的患者發生的不良反應,和發生率大於安慰劑組患者的不良反應。
短期、固定劑量、安慰劑對照試驗中,劑量依賴性不良反應
集合分析4個研究中劑量-反應關係表明,下列不良反應發生率與劑量明顯相關:乏力、體位低血壓、厭食、口乾、流涎增加,關節痛、焦慮、頭暈、肌張力障礙、肌張力亢進、嗜睡、震顫、鼻炎、皮疹和視覺異常。
錐體外系綜合症(EPS):短期,安慰劑對照試驗中,治療組和安慰劑組EPS的發生率分別為14%和8%。經Simpson-Angus測量表(主要評價EPS)和Barnes Akathisia表(主要評價靜坐不能)評估,治療組和安慰劑組間無差異。
肌張力障礙——本類藥物共有效應: 治療最初幾日,易感患者可能會出現以肌群異常收縮時間延長為表現的肌張力障礙症狀。 這些症狀包括:頸部肌肉痙攣,有時會進一步引起喉頭髮緊、吞咽困難、呼吸不暢、和/或伸舌困難。 雖然這些症狀在低劑量用藥時即可出現,但是這些症狀在使用高效價、高劑量的傳統抗精神病藥物治療時發生更為頻繁,程度更為嚴重。男性和年輕人群罹患急性肌張力障礙的風險增高。
生命體徵變化:齊拉西酮與體位性低血壓有關。
體重增加:集合分析4周和6周安慰劑對照臨床試驗,結果顯示齊拉西酮治療組和安慰劑組體重超過初始體重7%的患者比例分別為10%和4%,兩組比較差異有統計學意義。與安慰劑組相比,治療組體重平均增加0.5kg。在這些臨床試驗中,齊拉西酮治療組和安慰劑組出現體重增加的不良反應率分別為0.4%和0.4%。長期用齊拉西酮治療期間,根據基線體重指數(BMI,body mass index)對患者進行分組,結果顯示與體重正常(體重指數BMI=23-27)或體重過重(BMI]27)的患者相比,BMI較低(BMI[23)的患者平均體重增加最大、具有臨床意義的體重增加(體重的7%)的發生率也最高。基線BMI低的患者體重平均增加1.4kg,基線BMI正常的患者體重無變化,基線BMI高的患者體重平均降低1.3kg。
心電圖(ECG)變化:齊拉西酮與QTc間期增加有關,在治療精神分裂症的臨床試驗中,患者用齊拉西酮後心率平均增加1.4次/分,患者服安慰劑心率平均降低0.2次/分。
上市前口服齊拉西酮的其他不良反應
下面按身體系統對不良事件再次進行分類,並且按照下列定義的發生頻率進行排序:常見不良反應:發生率至少為1%;不常見不良反應:1/1000[發生率[1/100;罕見不良反應:發生率[1/1000。
全身:常見不良反應:腹痛、感冒樣症狀、發燒、意外跌倒、面部浮腫、寒戰、光敏反應、肋痛、體溫過低、駕駛機動車意外。
心血管系統:常見:心動過速、高血壓、體位性低血壓;不常見:心動過緩、心絞痛、心房顫動;罕見:1級AV傳導阻滯、束支傳導阻滯、靜脈炎、肺栓塞、心肌肥大、腦梗塞、腦血管意外、深度血栓性靜脈炎、心肌炎、血栓性靜脈炎。
消化系統:常見:厭食、嘔吐;不常見:直腸出血、吞咽困難、舌水腫;罕見:牙齦出血、黃疸、糞便嵌塞、γ-谷氨醯轉氨酶升高、嘔血、膽汁阻塞性黃疸、肝炎、肝腫大、口黏膜白斑病、脂肪肝、黑吐症。
內分泌系統:罕見:甲狀腺機能減退,甲狀腺機能亢進,甲狀腺炎。
血液淋巴系統:不常見:貧血、淤血、白細胞增多、白細胞減少、嗜曙紅細胞增多、淋巴結病;罕見:血小板減少、低色素性貧血、淋巴細胞增多、單核細胞增多、嗜鹼粒細胞增多、淋巴水腫、紅細胞增多症、血小板增多症。
代謝和營養性疾病:不常見:渴、轉氨酶升高、周圍性水腫、高血糖、肌酸磷酸激酶升高、鹼性磷酸酶升高、高膽固醇血症、脫水、乳酸脫氫酶升高、蛋白尿、低血鉀;罕見: BUN升高、肌酐升高、高血脂、血漿膽固醇降低、高血鉀、低血氯、低血糖、低血鈉、低蛋白血症、糖耐量異常、痛風、高氯血症、高尿酸血症、低鈣血症、低血糖性反應、低鎂血症、酮病、呼吸性鹼中毒。
肌肉骨骼系統: 常見:肌痛;不常見:腱鞘炎;罕見:肌病。
神經系統:常見:激越、錐體外系症狀、震顫、肌張力障礙、肌張力亢進、運動障礙、敵意、顫搐、感覺異常、意識混亂、眩暈、運動功能減退、運動功能增加、步態異常、動眼神經危象、感覺遲鈍、共濟失調、健忘症、齒輪樣強直、譫妄、肌張力減退、運動不能、發音困難、戒斷綜合徵、舞蹈症、復視、運動失調、神經病變;不常見:麻痹;罕見:肌陣攣、眼球震顫症、斜頸、口周感覺異常、角弓反張、反射增強、牙關緊閉症。
呼吸系統:常見:呼吸困難;不常見:肺炎,鼻衄;罕見:咳血、喉痙攣。
皮膚及附屬器官:不常見:斑丘疹、蕁麻疹、禿頂、濕疹、表皮脫落性皮炎、接觸性皮炎、水泡大皰疹。
特殊感覺:常見:真菌性皮炎;不常見:結膜炎、乾眼、耳鳴、瞼炎、白內障、畏光;罕見:眼出血、視野缺損、角膜炎、結膜炎。
泌尿生殖系統:不常見:陽痿、異常射精、閉經、血尿、月經過多、女性泌乳、多尿症、尿瀦留、子宮不規則出血、男性性功能障礙、性快感缺失、糖尿;罕見:男子女性型乳房、陰道出血、夜尿症、少尿、女性性功能障礙、子宮出血。
上市後的使用中觀察到的其他不良反應
上市後報告的、未在上面介紹的不良反應包括下面這些不良反應,根據發生率的定義,屬於罕見不良反應(並且尚未確定與齊拉西酮治療的因果關係):心臟疾病:心動過速、尖端扭轉型室性心律失常(同時有很多混雜因素-參見注意事項)。生殖系統和乳腺疾病:溢乳;神經系統疾病:精神抑制藥惡性綜合徵;精神疾病:失眠;皮膚及皮下組織疾病:過敏性反應、皮疹;血管疾病:體位性低血壓。
在中國進行的驗證性臨床研究中,最常見的、各種原因引起的不良反應主要發生在中樞神經系統(CNS),包括:靜坐不能、錐體外系症狀、嗜睡、運動障礙、頭暈等。主要為輕度和中度。118例接受齊拉西酮治療的患者中,有1例出現QTc間期 ] 500 毫秒 (511毫秒),1例出現ECG的不完全右束枝傳導阻滯,導致患者退出研究。2例患者均無臨床症狀,停藥後恢復正常。
兒童和青少年人群
在一項安慰劑對照的雙相情感障礙試驗(年齡10-17歲)中,最常見的不良反應(報告頻率>10%)為鎮靜、嗜睡、頭痛、疲乏、噁心和頭暈。在一項安慰劑對照的精神分裂症試驗(年齡13-17歲)中最常見的不良反應(報告頻率>10%)為鎮靜和椎體外系障礙。這些受試者不良反應的頻率、類型和嚴重程度與使用齊拉西酮治療的成年雙相情感障礙或精神分裂症患者基本相似。
在雙相情感障礙和精神分裂症兒童臨床試驗中,服用齊拉西酮後,可出現輕到中度的劑量相關性QT間期延長,在成人中也觀察到相似結果。
禁忌
1.QT間期延長
齊拉西酮劑量依賴性延長QT間期,並且已經證實一些延長QT間期的藥物與致死性心律不齊有關。具有QT間期延長病史的患者(包括先天性長QT間期綜合徵)、近期出現急性心肌梗塞的患者和非代償性心衰的患者禁用齊拉西酮。
齊拉西酮禁忌與在藥效學方面能夠延長QT間期的藥物、或者在處方信息中禁忌用於QTc間期延長患者的藥物、以及有黑框警告慎重用於QTc間期延長患者的藥物合用。齊拉西酮不應與多非利特、索他洛爾、奎尼丁、其他Ia 和 III 類抗心律失常藥、美索達嗪、硫利達嗪、氯丙嗪、氟派利多、匹莫齊特、司帕沙星、加替沙星、莫西沙星、鹵泛群、甲氟喹、噴他脒、三氧化砷、左醋美沙朵(levomethadyl acetate)、甲磺酸多拉司瓊、丙丁酚和他克莫司等合用。
2.對本品過敏的患者禁用。
注意事項
1.與痴呆有關的老年精神病患者死亡率增加。
與安慰劑相比,與痴呆有關的老年精神病患者服用非典型抗精神病藥物後死亡率有增加的風險。齊拉西酮未批准用於治療痴呆相關的精神病(見警示語)。
2.伴痴呆的老年患者的腦血管不良事件(包括卒中)
在痴呆人群中使用某些非典型抗精神病藥物進行的隨機、安慰劑對照臨床試驗中發現:上述藥物治療組的腦血管不良事件發生風險增加約3倍。尚不清楚該風險增加的機制。對於其它抗精神病藥物或其他人群,也不能排除腦血管不良事件增加的風險。具有卒中危險因素的患者應慎用齊拉西酮。
3.齊拉西酮治療引起 QTc 延長,比四種對照藥物(利培酮、奧氮平、喹硫平和氟哌啶醇)對 QTc的影響長約 9-14 毫秒,但是比硫利噠嗪約短 14 毫秒。一些能延長 QT/QTc間期的藥物被認為與尖端扭轉型室性心動過速(torsade de pointes)的發生及猝死有關。QT/QTc 間期延長與尖端扭轉型室性心動過速的關係在 QT/QTc間期增加幅度較大時(增加幅度超過 20 毫秒)比較明確,但是 QT/QTc間期延長幅度較小時,也會增加尖端扭轉型室性心動過速的發生風險,或者在一些易感個體增強其發生的風險,比如有低鉀血症、低鎂血症或遺傳易感個體。儘管在上市前臨床研究中,患者服用推薦劑量齊拉西酮尚未出現尖端扭轉型室性心動過速(torsade de pointes) ,但因經驗太少,尚不能排除其潛在的風險。罕見上市後尖端扭轉型室性心動過速的報告(多重混雜因素並存的情況下) 。與其他幾種抗精神病藥相比,齊拉西酮延長 QTc 間期的作用較強,增加了治療過程中猝死的風險。這種可能性在選擇治療藥物時應予以高度重視。
一些藥物延長QT/QTc間期致其大於500毫秒,可發生尖端扭轉型室性心動過速和不明原因的猝死。在多重混雜風險因素並存的情況下,服用齊拉西酮的患者有發生上市後尖端扭轉型室性心動過速的罕見報告,其與齊拉西酮的因果關係尚未確定。
在某些特定情況下,套用可延長 QTc 間期的藥物後,可能增加出現尖端扭轉型室性心動過速和/或猝死的危險。這些情況包括: (1)心動過緩; (2)低鉀或低鎂血症; (3)同時服用其他可以導致 QTc間期延長的藥物; (4)患者有先天性 QT 間期延長。
4.低血鉀或低血鎂能增加QT延長和心律不齊的風險。低血鉀/鎂的患者在治療前應補充電解質。齊拉西酮治療期間又服用利尿劑的患者,應定期監測血清電解質。有嚴重心血管疾病病史的患者,如QT間期延長、近期內的急性心肌梗塞、失代償性心衰或者心律失常的患者,應避免接受齊拉西酮治療。如果發現患者出現了持續性QTc ]500 毫秒,應停用齊拉西酮。
5.服用齊拉西酮後出現了提示有尖端扭轉型室性心律失常發生的症狀(如頭暈、心悸、昏厥等)的患者,醫生套用Holter監測法對患者作進一步評價。
6.惡性綜合徵(NMS)
已經有報導抗精神病藥治療可以誘發一組致死性的複合症狀群,統一命名為“惡性綜合徵”(NMS)。NMS的臨床症狀為:高熱、肌僵、精神狀態改變和植物神經系統功能紊亂(如:脈博不規律和血壓不穩、心動過速、出汗和心律失常);其他體徵包括:肌酐磷酸酶升高、蛋白尿和急性腎衰。
套用齊拉西酮也有發生NMS的可能,NMS的處理包括:(1)一旦發生應立即停止抗精神病藥以及其他非必須使用的藥物治療;(2)並進行相應對症支持治療和密切監測;(3)如果合併其他嚴重軀體疾病,應當採取特殊的治療措施積極治療。目前對於NMS尚無公認的特效治療方法。
如患者恢復後需要再次使用抗精神病藥物,應慎重考慮選擇適當的抗精神病藥治療。須對患者情況進行密切監測,因有報導有復發NMS的可能。
7.遲發性運動障礙(TD)
使用齊拉西酮時應採取儘可能減少TD發生的給藥方式。如果用齊拉西酮治療的患者出現遲發性運動障礙的症狀或體徵,應考慮停藥;但有些患者即使出現該症狀,仍需要繼續服用齊拉西酮治療。
8. 高血糖症和糖尿病
在套用非典型抗精神病藥物的患者中,已有嚴重高血糖症並伴酮症酸中毒、高滲性昏迷或死亡的病例報告。在服用齊拉西酮的患者中幾乎沒有高血糖症或糖尿病的報告。但尚不清楚齊拉西酮很少有此不良反應報告是否僅與臨床使用尚少有關。精神分裂症患者患糖尿病風險增加的可能性以及普通人群中不斷增加的糖尿病發病率,使非典型抗精神病藥物和血糖異常之間關係的評價複雜化。考慮到這些混雜因素,非典型抗精神病藥物的使用和高血糖相關不良事件之間的關係尚未完全明確。然而,流行病學研究(不包括齊拉西酮)顯示在納入研究的、接受非典型抗精神病藥物治療的患者中,由治療引發的高血糖相關不良事件的風險增加。由於在進行上述研究時齊拉西酮尚未上市,故尚不清楚本品是否與該風險增加有關。尚無法精確評估服用非典型抗精神病藥物的患者出現高血糖相關不良事件的風險。
已確診糖尿病的患者在開始非典型抗精神病藥物治療後,應對血糖進行定期監測。伴有糖尿病危險因素(例如肥胖、糖尿病家族史)的患者應在開始非典型抗精神病藥物治療及治療期間定期測定空腹血糖。所有服用非典型抗精神病藥物的患者均應監測高血糖症狀,包括多飲,多尿,多食和虛弱。在非典型抗精神病藥物治療期間出現高血糖症狀的患者應測定空腹血糖。在一些病例中,停用非典型抗精神病藥物後高血糖症緩解,然而,有的患者停用可疑藥物後仍需繼續抗糖尿病治療。
9.皮疹:在齊拉西酮的上市前試驗中,約5%的患者出現皮疹/蕁麻疹,因此停藥的患者約為1/6。皮疹的發生率與齊拉西酮的劑量有關,但是也可能是因為患者較長時間接受高劑量藥物治療的緣故。幾例皮疹患者,出現了相關的全身症狀和體徵,如WBCs計數增加。絕大多數患者用抗組胺藥、類固醇或停藥等輔助措施就能迅速改善症狀。出現不能確定病因的皮疹時,應停用齊拉西酮。
10.體位性低血壓:齊拉西酮可能引起一些患者發生體位性低血壓,出現頭暈、心動過速、昏厥等,特別是在用藥初期和劑量調整期。這可能與齊拉西酮的α1-腎上腺素拮抗劑特性有關。齊拉西酮誘發昏厥的發生率為0.6%。
有心血管病史(心肌梗塞、缺血性心臟病、心衰或傳導異常)、腦血管病史或易於出現低血壓的軀體疾病病史(脫水、血容量不足和服用抗高血壓藥)的患者應慎用齊拉西酮。
11.癲癇:臨床試驗期間,齊拉西酮誘發癲癇的發生率為0.4%。造成癲癇的原因十分複雜,和其他抗精神病藥一樣,有癲癇病史或癲癇發生閾值降低(如阿爾茨海默病,即早老性痴呆)的患者應慎用齊拉西酮。在65歲以上的人群中,患有癲癇發生閾值降低的疾病比較普遍。
12.吞咽困難:食管運動異常和誤吸均可能與服用抗精神病藥有關。有吸入性肺炎風險的患者,應慎用齊拉西酮和其他抗精神病藥。
13.高催乳素血症:與其他多巴胺D受體拮抗劑一樣,齊拉西酮能升高人體內催乳素水平。約1/3的人患乳腺癌可能是催乳素依賴性的。可升高催乳素的化合物已有如溢乳、閉經、男子女性型乳房和陽痿的報告。確診為乳腺癌的患者應慎重考慮是否服用齊拉西酮。截至目前的臨床研究和流行病學研究表明,長期服用齊拉西酮與精神病人腫瘤的發生無關。現有的資料太少,還不適宜作出最後的結論。當長期高催乳素血症伴性腺功能減退時,可能導致骨密度降低。
14.潛在損害認知和運動功能:齊拉西酮最常見的不良反應為嗜睡。在4-6周安慰劑對照試驗中,齊拉西酮和安慰劑組嗜睡的發生率分別為14%和7%。在短期臨床試驗中,因嗜睡導致脫落的患者比例為0.3%。服藥期間患者應謹慎從事需要精神支配的活動,如駕駛機動運輸工具或駕駛具有危險性的機械,直到有理由確認,齊拉西酮治療不會對上述活動產生不良影響為止。
15.陰莖異常勃起:上市前的資料中僅1例患者出現陰莖異常勃起。陰莖異常勃起與齊拉西酮之間的關係尚未確定。具有α-腎上腺素能受體阻斷作用的藥物能誘發陰莖異常勃起,本品可能具有誘發陰莖異常勃起的作用。與其他精神類藥物一樣,該不良反應無劑量依賴性,且與治療持續時間無關。嚴重的勃起異常可能需要手術治療。
16. 體溫調節:儘管上市前沒有齊拉西酮影響體溫調節功能的報導,但由於抗精神病藥具有干擾體溫調節中樞的能力,建議如果患者患有導致體溫升高的狀況時,如過度運動、暴露在極熱環境中、服用抗膽鹼能的藥物或處於脫水狀態時,應慎用齊拉西酮。
17.自殺:精神疾病患者均具有潛在的自殺意圖,藥物治療期間應密切監測高風險患者。處方齊拉西酮的藥量應為有效控制症狀的最小劑量,以降低藥物過量風險。
18.合併其他疾病患者的用藥:齊拉西酮用於治療伴某些其他全身性疾病患者的臨床經驗十分有限,還未系統評價在近期患有心肌梗塞或不穩定性心臟病患者中使用齊拉西酮的療效。心臟病患者應慎用齊拉西酮。
19.CNS藥物/酒精:鑒於齊拉西酮主要作用於CNS,應謹慎與其他作用於中樞的藥物合用,這些藥物包括酒精及作用於多巴胺能和5-羥色胺能系統的藥物。
孕婦及哺乳期婦女用藥
尚未在妊娠婦女中進行充足的、設計良好的對照臨床試驗。應建議有生育能力的婦女在服用齊拉西酮時使用適當的避孕方法。鑒於人體使用經驗有限,不建議在妊娠期間套用齊拉西酮。
非致畸類效應:妊娠晚期暴露於抗精神病藥物(包括齊拉西酮)的新生兒在分娩後存在出現椎體外系神經異常和/或戒斷症狀的風險。有上市後報告在上述新生兒中出現激越,肌張力增強,肌張力減退,震顫,嗜睡,呼吸窘迫和餵養困難等。這些併發症的嚴重程度不同;在有些病例中症狀為自限性,而在另一些病例中新生兒需要額外的藥物治療或監測。
齊拉西酮僅應在預期收益大於風險時才在妊娠期間套用,而且給藥劑量應儘可能低、療程儘可能短。
目前尚不清楚齊拉西酮是否分泌入母乳中,服用齊拉西酮的婦女不應哺乳。
兒童用藥
兒童患者使用齊拉西酮的安全性和療效尚未評估。
老年用藥
應降低起始劑量、緩慢調整劑量,並密切監測患者。
藥物相互作用
(1)齊拉西酮不應與延長QT間期的藥物合用。
(2)齊拉西酮主要作用於中樞神經系統,與其他作用於中樞的藥物合用時應十分謹慎。
(3)齊拉西酮可能誘發低血壓,因此可能會增強某些抗高血壓藥物的療效。
(4)齊拉西酮可能拮抗左旋多巴胺和多巴胺激動劑的作用。
其他藥物對齊拉西酮的影響
卡馬西平:卡馬西平為CYP3A4誘導劑,每天2次連續21天服用200mg卡馬西平,患者齊拉西酮的AUC降低約35%。卡馬西平劑量越高,齊拉西酮的AUC降得越多。
酮康唑:酮康唑為強效CYP3A4抑制劑,患者每天服用400mg酮康唑,連續5天,齊拉西酮的AUC和Cmax增加約35-40%。其他CYP3A4抑制劑有相似的作用。
西米替丁:800mg西米替丁,每日一次,服用2天,對齊拉西酮藥代動力學無影響。
制酸劑:合用30mL抗酸劑(Maalox®),對齊拉西酮藥代動力學無影響。
此外,在對照臨床試驗中,對入組的精神分裂症患者進行的群體藥代動力學分析表明,與苯扎托品、普萘洛爾和勞拉西泮合用,齊拉西酮的藥代動力學無顯著性改變。
齊拉西酮對其他藥物的影響
體外試驗表明,與主要經CYP1A2、CYP2C9、CYP2C19、CYP2D6和CYP3A4清除的藥物合用,齊拉西酮不會干擾其代謝。幾乎沒有因為置換作用而造成齊拉西酮與其他藥物間的相互作用。
鋰:齊拉西酮(40mg ,BID)、與鋰(450mg ,BID)合用7天,不會影響鋰的穩態血藥濃度或腎清除率。
口服避孕藥:齊拉西酮(20mg ,BID)與口服避孕藥炔雌醇(0.03mg)和左炔諾孕酮(0.15mg)合用,不會影響這兩種口服避孕藥的藥代動力學。
右美沙芬:與體外試驗結果一致,一項在健康志願者中進行的研究結果顯示,齊拉西酮不會改變CYP2D6的底物-右美沙芬代謝生成其主要代謝產物右啡烷的過程。尿中右美沙芬/右啡烷的比值無顯著性改變。
與血漿蛋白結合的藥物:齊拉西酮與血漿蛋白廣泛結合。體外研究顯示,華法林或普萘洛爾這兩種高血漿蛋白結合的藥物並不改變齊拉西酮的血漿蛋白結合狀況,齊拉西酮也不改變這些藥物的結合狀況。因此,不太可能因置換作用發生與齊拉西酮的藥物相互作用。
藥物過量
人體藥物過量經驗:在5400例患者或正常受試者參加的上市前的臨床試驗中,偶然或有意過量使用齊拉西酮共10人,所有這些患者均完全恢復正常,未出現後遺症。服最大劑量3240mg的患者僅出現如下不良反應:輕度鎮靜、言語不清和一過性高血壓(200/95)。
上市後的使用中,報告的與齊拉西酮過量相關的不良反應主要包括:錐體外系症狀、嗜睡、震顫和焦慮。
過量處理:一旦出現急性過量,建立並保持通風,確保氧氣充足。可以靜脈輸液或洗胃(如果患者不清醒,可插管,插管後洗胃),考慮瀉藥與活性炭一起使用。過量用藥後可能出現頭頸部感覺遲鈍、癲癇發作或張力障礙反應,這可能導致吸入風險,誘發嘔吐。
立即監測心血管功能並持續監測心電圖,以發現可能出現的心律失常。如果服藥治療心律失常,需謹慎套用丙吡胺、鹽酸普魯卡因胺和奎尼丁,因為理論上這些藥物可能增加齊拉西酮致QT間期延長的風險。
採取適當的措施,如靜脈輸液的方式處理低血壓和循環衰竭,如果使用擬交感神經藥物改善血管功能,就不能使用腎上腺素和多巴胺,因為β1激動作用加上齊拉西酮的α1拮抗作用可能加劇低血壓。同樣地,溴苄胺(抗心律失常藥)的a腎上腺素阻斷特性可能會協同齊拉西酮的這方面作用,也可能加重低血壓,使問題複雜化。
對嚴重的錐體外系症狀,可用抗膽鹼能藥物處理。齊拉西酮過量時,無特殊的解毒藥,也不能透析。可以考慮使用多種藥物進行對症處理。應密切進行醫學觀察和監測,直到患者康復。
臨床試驗
國外上市前對本品進行了以下研究:
三個短期(4周和6周研究)和一個長期(52周研究)對照研究評價了齊拉西酮治療符合DSM-III-R精神分裂症或分裂情感性精神障礙診斷標準的住院患者的療效,這些研究中使用了幾個評估工具評定精神病性症狀和體徵,包括簡明精神疾病評定量表(BPRS)和陽性和陰性症狀評定量表(PANSS),這兩個量表包括多項精神心理學條目,經常用在評價藥物治療精神疾病療效的研究中。
另一個傳統的評估工具,是臨床總體印象量表(CGI),反映了有經驗的對精神分裂症症狀表現非常熟悉的評估者對患者總體臨床狀態的印象。另外,在一些臨床研究中,還使用了陰性症狀量表(SANS)和蒙哥馬利抑鬱量表(MADRS)。
在這項52-周的安慰劑對照維持治療研究中 (N=294),齊拉西酮劑量20、40和80mg,BID,預防疾病的復發的效果明顯優於安慰劑治療,BPRS總分和精神症狀因子分、CGI、PANSS總分和陰性症狀分量表分以及由於社會功能的總體印象量表評分,都明顯優於安慰劑。齊拉西酮和安慰劑治療由於不良反應而停藥的比例分別是7-10%,安慰劑組為15%。
兩個多中心、安慰劑對照研究中,評價了齊拉西酮治療急性精神分裂症患者,伴有臨床意義的抑鬱症狀(MADRS ³14),經齊拉西酮治療後抑鬱症狀明顯改善,一項研究中,齊拉西酮劑量為60mg,每日兩次;另一項研究中,齊拉西酮劑量為80mg,每日兩次;MADRS評分與安慰劑組比較,療效差異具有統計學顯著性 (p [ 0.05)。
藥理毒理
藥理作用
齊拉西酮是一種非典型抗精神病藥,其結構與吩噻嗪類或丁醯苯類抗精神病藥物不同。體外研究顯示,齊拉西酮對多巴胺D2、D3、5-羥色胺5HT2A、5HT2C、5HT1A、5HT1D、a1-腎上腺素能受體具有較高的親和力,對組胺H1受體具有中等親和力,對包括M膽鹼能受體在內的其他受試受體/結合位點未見親和力。齊拉西酮對D2、5HT2A、5HT1D受體具有拮抗作用,對5HT1A受體具有激動作用。齊拉西酮能抑制突觸對5-羥色胺和去甲腎上腺素的再攝取。
與其他抗精神分裂症藥物一致,齊拉西酮的作用機制不明確。研究認為其抗精神分裂症作用可能是通過對D2和5HT2 受體的拮抗作用來發揮的,對其他相似親和力受體的拮抗作用可能是導致其他治療作用和副作用的原因。對H1受體的拮抗作用可能是齊拉西酮產生嗜睡的原因,對a1-腎上腺素能受體的拮抗作用可是產生體位性低血壓的原因。
毒理研究
遺傳毒性 Ames試驗中,在無代謝活化時齊拉西酮可使一株鼠傷寒沙門氏菌回復突變率升高。小鼠淋巴瘤細胞基因突變試驗、人淋巴細胞染色體畸變試驗結果均為陽性,小鼠微核試驗結果為陰性。
生殖毒性 SD大鼠在齊拉西酮劑量為10~160mg/kg/天(按mg/m2推算,相當於人最大推薦劑量200mg/天的0.5~8倍)時可見交配時間延長,在劑量為160mg/kg/天時生育力降低,在劑量為40mg/kg/天時對生育力未見影響。雄性大鼠在劑量為160mg/kg/天時與未給藥雌性大鼠交配後,未見生育力降低,因此齊拉西酮可能僅對雌性大鼠的生育力有影響。在一項周期為6個月的大鼠試驗中,給藥劑量為200mg/kg(按mg/m2推算,相當於人最大推薦劑量200mg/天的10倍),未見對睪丸的影響。
大鼠致畸敏感期給予齊拉西酮10~160mg/kg/天,可見胎仔體重降低、骨骼骨化延遲,但未見畸形,對發育無影響劑量為5mg/kg/天。在劑量為40和160mg/kg時可見母體毒性。家兔致畸敏感期給予齊拉西酮30mg/kg/天(按mg/m2推算,相當於人最大推薦劑量200mg/天的3倍)可見胎仔結構畸形發生率增加,對發育無影響劑量為10mg/kg/天。
大鼠圍產期給予齊拉西酮10mg/kg/天(按mg/m2推算,相當於人最大推薦劑量200mg/天的0.5倍)或更高劑量,死產數增加,哺乳前4天存活動物數減少。在劑量為5mg/kg/天(按mg/m2推算,相當於人最大推薦劑量200mg/天的0.2倍)時,可見子代動物發育延遲和神經行為功能受損。
致癌性 Long Evans大鼠和CD-1小鼠摻食法分別給予齊拉西酮2、6、12mg/kg/天或50、100、200mg/kg/天(按mg/m2推算,分別相當於人最大推薦劑量200mg/天的0.1~0.6倍和1~5倍),連續24個月。與對照組比較,大鼠和雄性小鼠中未見腫瘤發生率增加。在雌性小鼠中,可見垂體腺瘤和垂體癌、乳腺癌發生率呈劑量依賴性增加。嚙齒類動物長期給予其他抗精神病藥物可見垂體和乳腺增生,認為是催乳素介導的。小鼠摻食法給予齊拉西酮100 、200 mg/kg/天,連續1個月,可見雌性小鼠血清催乳素水平升高,雄性小鼠無影響。用大鼠摻食法給予齊拉西酮也未見催乳素改變。嚙齒類動物中催乳素介導的內分泌腫瘤對人體用藥風險的相關性尚不明確。
藥代動力學
齊拉西酮的藥理活性主要來自原形藥物。口服鹽酸齊拉西酮後經胃腸道吸收良好,分布廣泛,6-8小時達血漿峰濃度,1—3天達到穩態血濃度,血漿蛋白結合率大於99%,齊拉西酮的平均表觀分布容積為1.5L/kg,餐時服用20mg藥物的絕對生物利用度約為60%,食物能增加本品的吸收約2倍。在推薦的臨床劑量範圍內,齊拉西酮的平均終末半衰期(T1/2)約為7小時,平均表觀系統清除率為7.5mL/min/kg。血漿蛋白結合率大於99%。口服齊拉西酮後主要經肝臟充分代謝,僅少量原形藥經尿液([1%)和糞便([4%)排泄。齊拉西酮主要經三種代謝途徑消除、生成四種主要的循環代謝產物:苯並異噻唑(BITP)亞碸、BITP-碸、齊拉西酮亞碸和S-甲基-二氫齊拉西酮。經尿液和糞便排泄的藥物分別約為20%和66%,血清中原形齊拉西酮約為44%。體外人肝細胞組分研究表明,經兩步生成S-甲基-二氫齊拉西酮。體外人肝微粒體和重組酶研究表明,氧化代謝齊拉西酮的CYP酶主要是CYP3A4,CYP1A2的作用較弱。在體分泌和代謝資料表明,不足1/3的齊拉西酮經細胞色素P450氧化代謝消除,約2/3齊拉西酮經醛氧化酶代謝清除。對醛氧化酶有臨床意義的抑制劑或激動劑情況尚不清楚。
年齡、性別和種族對齊拉西酮藥代動力學無影響。不需要調整劑量。
吸菸:體外人肝細胞酶進行的研究表明,齊拉西酮不是CYP1A2酶的底物,吸菸應該對齊拉西酮的藥代動力學無影響。群體藥代動力學研究結果與體外研究結果一致,群體藥代動力學研究表明,吸菸和不吸菸對齊拉西酮的藥代動力學無影響。
腎損傷:齊拉西酮代謝率高,經腎分泌的原形藥物低於1%,單獨腎損傷對齊拉西酮的藥代動力學無明顯影響,不需根據腎功能損傷程度調整用藥劑量。
肝損傷:齊拉西酮主要經肝臟清除,肝損傷會導致齊拉西酮AUC增加。對13例Childs-Pugh A型和B型壞死性肝炎受試者進行的多劑量(20mg,每日兩次,連續5天)研究結果顯示,Childs-Pugh A型和B型受試者與相匹配的對照者(n=14)比較,AUC 0-12 分別增加13%和34%。肝損害者的半衰期為7.1小時,而對照者為4.8小時。在狗體進行的毒理研究,當給予口服藥物,藥物暴露(血漿AUC)是最大臨床暴露量2倍的劑量時,出現肝內膽汁淤積和血清ALT升高、鹼性磷酸酶升高。在嚴重肝臟功能損害患者中使用齊拉西酮的經驗還不足,因此,在這組患者中,應謹慎使用齊拉西酮。
研發歷程
齊拉西酮針劑
2000年在瑞典上市,2002年在美國上市,已先後在世界範圍內77個國家和地區上市。
2013年在中國上市,用於治療精神分裂症患者的急性激越症狀。
ZELDOX膠囊
2001年在美國上市,用於治療精神分裂症。2004年被批准用於雙相障礙-急性躁狂發作/混合發作。2009年批准用於雙相障礙維持期輔助治療。
2007年,ZELDOX膠囊在我國上市,中文名為卓樂定膠囊,被批准用於治療精神分裂症。
貯藏
30℃以下室溫保存。
包裝
 卓樂定
卓樂定鋁/鋁泡眼,4粒/盒,10粒/盒。
有效期
60個月。
執行標準
進口藥品註冊標準 JX20100207
批准文號
進口藥品註冊證號:
(1)20mg: H20110464
(2)40mg: H20110461
(3)60mg: H20110462
(4)80mg: H20110463
生產企業
Pfizer Australia Pty Limited
核准日期
2007年01月10日
修訂日期
2009年07月03日 2010年12月27日 2011年09月06日 2011年11月05日 2012年02月21日 2012年06月25日 2012年11月08日