成份
 凱西萊
凱西萊本品主要成份:硫普羅寧,輔料為右旋糖酐40。
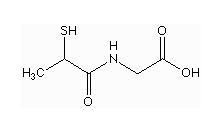
硫普羅寧的化學名稱為:N-(2-巰基丙醯基)-甘氨酸,
化學結構式為:
分子式:CHNOS
分子量:163.20
性狀
本品為白色疏鬆塊狀物。
適應症
1、用於改善各類急慢性肝炎的肝功能。
2、用於脂肪肝、酒精肝、藥物性肝損傷及重金屬的解毒。
3、用於降低放化療的不良反應,並可預防放化療所致的外周白細胞減少。
4、用於老年性早期白內障和玻璃體渾濁。
規格
0.1g
用法用量
靜脈滴注,一次2支,一日一次,連續4周。
配製方法:臨用前將每0.1g注射用硫普羅寧先用5%的碳酸氫鈉注射液2ml溶解,再擴溶至5%-10%的葡萄糖溶液或0.9%氯化鈉注射液250-500ml中,按常規靜脈滴注。
不良反應
1.過敏反應:在硫普羅寧注射劑型上市後收集的1560例不良反應病例報告中,嚴重不良反應病例報告115例,主要表現為過敏性休克的79例(死亡1例)。其他不良反應還有皮疹、瘙癢、噁心、嘔吐、發熱、寒戰、頭暈、心慌、胸悶、頜下腺腮腺腫大、喉水腫、呼吸困難、 過敏樣反應等。
2.本藥可能引起青黴胺所具有的所有不良反應,但其不良反應的發生率較青黴胺低。
3.血液系統:少見粒細胞缺乏症,偶見血小板減少,如果外周白細胞計數降到每毫升3.5×106 以下,或者血小板計數降到每毫升10×106 以下,建議停藥。
4.泌尿系統:可出現蛋白尿,發生率約為10%,停藥後通常很快即可完全恢復。另有個案報導本藥可引起尿液變色。
5.消化系統:可出現味覺減退、味覺異常、噁心、嘔吐、腹痛、腹瀉、食慾減退、胃脹氣、口腔潰瘍等。另有報導可出現膽汁淤積、肝功能檢測指標(如丙氨酸氨基轉移酶、天門冬氨酸氨基轉移酶、總膽紅素、鹼性磷酸酶等)上升,如出現異常應停用本品,或進行相應治療。
6.皮膚:皮膚反應是本藥最常見的不良反應,發生率約為10%~32%,表現為皮疹、皮膚瘙癢、皮膚發紅、蕁麻疹、皮膚皺紋、天皰瘡、皮膚眼睛黃染等,其中皮膚皺紋通常僅在長期治療後發生。
7.呼吸系統:據報導,本藥可引起肺炎、肺出血和支氣管痙攣。另有個案報導可出現呼吸困難或呼吸窘迫,以及閉塞性細支氣管炎。
8.肌肉骨骼:有個案報導使用本藥治療可引起肌無力。
9.長期、大量套用罕見蛋白尿或腎病綜合症。
10.其它:罕見胰島素性自體免疫綜合症,出現疲勞感和肢體麻木應停用。
禁忌
以下患者禁用:
1.對本品成份過敏的患者。
2.重症肝炎並伴有高度黃疸、頑固性腹水、消化道出血等併發症的肝病患者。
3.腎功能不全合併糖尿病者。
4.孕婦及哺乳婦女。
5.兒童。
6.急性重症鉛、汞中毒患者。
7.既往使用本藥時發生過粒細胞缺乏症、再生障礙性貧血、血小板減少或其它嚴重不良反應者。
注意事項
1.出現過敏反應的患者應停用本藥。
以下患者慎用
(1)老年患者。
(2)有哮喘病史的患者。
(3)既往曾使用過青黴胺或使用青黴胺時發生過嚴重不良反應的患者。對於曾出現過青黴胺毒性的患者,使用本藥應從較小的劑量開始。
2.用藥前後及用藥時應定期進行下列檢查以監測本藥的毒性作用:外周血細胞計數、血小板計數、血紅蛋白量、血漿白蛋白量、肝功能、24小時尿蛋白。此外,治療中每3個月或每6個月應檢查一次尿常規。
孕婦及哺乳期婦女用藥
妊娠期婦女禁用本藥。美國藥品食品管理局(FDA)對本藥的妊娠安全性分級為C級。
本藥可通過乳汁分泌,有使乳兒發生嚴重不良反應的潛在危險,故哺乳婦女禁用。
兒童用藥
禁用。
老年用藥
未進行該項實驗且無可靠參考文獻。
藥物相互作用
本藥不應與具有氧化作用的藥物合用。
藥物過量
當用藥過量時,短時間內可引起血壓下降,呼吸加快,此時應立即停藥,同時應監測生命體徵並予以支持對症處理。
藥理毒理
硫普羅寧是一種與青黴胺性質相似的含巰基藥物,具有保護肝臟組織及細胞的作用。動物試驗顯示,硫普羅寧能夠通過提供巰基,防止四氯化碳、乙硫氨酸、對乙醯氨基酚等造成的肝臟損害,並對慢性肝損傷的甘油三酯的蓄積有抑制作用。硫普羅寧可以使肝細胞線粒體中ATP酶的活性降低,從而保護肝線粒體結構,改善肝功能。此外,硫普羅寧還可以通過巰基與自由基的可逆結合,清除自由基。
藥代動力學
給大鼠口服硫普羅寧(MPG),自尿中排泄量較低(0.015%),靜脈注射後尿中排泄量則明顯增高(22.35%)。靜脈注射後血中水平高,且至30分鐘均可檢出,口服60分鐘血漿達高峰,直至120分鐘可檢出。
在人體口服、肌內注射後,尿中排泄量相近(肌注為10%~12%,口服15.47%),但肌注後排泄時間延長,需8~24小時,血漿水平也較口服為高。
貯藏
遮光,密封,在陰涼(不超過20℃)處保存。
包裝
低硼矽玻璃管制注射劑瓶、藥用溴化丁基橡膠塞;(6支注射用硫普羅寧+6支專用溶劑)/盒。
有效期
24個月。
執行標準
國家食品藥品監督管理局國家藥品標準WS -(X-001)-2005Z
批准文號
國藥準字H10960086
生產企業
河南省新誼藥業股份有限公司
核准日期
2007年04月17日
修訂日期
2012年03月08日

