原理
 凱氏定氮法反應式為:
凱氏定氮法反應式為:蛋白質是含氮的有機化合物。食品與硫酸和催化劑一同加熱消化,使蛋白質分解,分解的氨與硫酸結合生成硫酸銨。然後鹼化蒸餾使氨游離,用硼酸吸收後再以硫酸或鹽酸標準溶液滴定,根據酸的消耗量乘以換算係數,即為蛋白質含量。
1.有機物中的氮在強熱和CuSO4,濃H2SO4作用下,消化生成(NH4)2SO4反應式為:
2NH2(CH2)2COOH+13H2S04=(NH4)2S04+6C02+12S02+16H22.在凱氏定氮器中與鹼作用,通過蒸餾釋放出NH3,收集於H3BO3溶液中反應式為:
(NH4)2SO4+2NAOH=2NH3+2H2O+NA2SO4
2NH3+4H3BO3=(NH4)2B4O7+5H2O
3.用已知濃度的HCI標準溶液滴定,根據HCI消耗的量計算出氮的含量,然後乘以相應的換算因子,既得蛋白質的含量
反應式為:
(NH4)2B407+H2S04+5H20=(NH4)9SO4+4H2BO2
(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3
試劑
所有試劑均用不含氨的蒸餾水配製。
2.1硫酸銅。
2.2硫酸鉀。
2.3硫酸。
2.42%硼酸溶液。
2.5混合指示液:1份0.1%甲基紅乙醇溶液與5份0.1%溴甲酚綠乙醇溶液臨用時混合。也可用2份0.1%甲基紅乙醇溶液與1份0.1%次甲基藍乙醇溶液臨用時混合。
2.640%氫氧化鈉溶液。
2.70.05N硫酸標準溶液或0.05N鹽酸標準溶液。
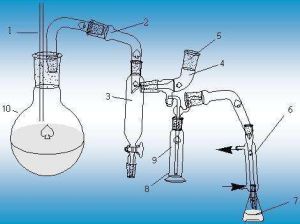
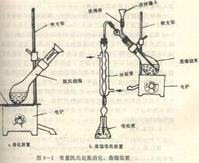
儀器
定氮蒸餾裝置:1.安全管
2.導管
3.汽水分離管
4.樣品入口
5.塞子
6.冷凝管
7.吸收瓶
8.隔熱液套
9.反應管
10.蒸汽發生瓶
操作方法
1、樣品處理:精密稱取0.2-2.0g固體樣品或2-5g半固體樣品或吸取10-20ml液體樣品(約相當氮30-40mg),移入乾燥的100ml或500ml定氮瓶中,加入0.2g硫酸銅,3g硫酸鉀及20毫升硫酸,稍搖勻後於瓶口放一小漏斗,將瓶以45度角斜支於有小孔的石棉網上,小火加熱,待內容物全部炭化,泡沫完全停止後,加強火力,並保持瓶內液體微沸,至液體呈藍綠色澄清透明後,再繼續加熱0.5小時。取下放冷,小心加20ml水,放冷後,移入100ml容量瓶中,並用少量水洗定氮瓶,洗液併入容量瓶中,再加水至刻度,混勻備用。取與處理樣品相同量的硫酸銅、硫酸鉀、硫酸銨同一方法做試劑空白試驗。
2、裝好定氮裝置,於水蒸氣發生器內裝水約2/3處加甲基紅指示劑數滴及數毫升硫酸,以保持水呈酸性,加入數粒玻璃珠以防暴沸,用調壓器控制,加熱煮沸水蒸氣發生瓶內的水。
3、想接收瓶內加入10ml2%硼酸溶液及混合指示劑1滴,並使冷凝管的下端插入液面下,吸取10.0ml樣品消化液由小玻璃杯流入反應室,並以10ml水洗滌小燒杯使流入反應室內,塞緊小玻璃杯的棒狀玻璃塞。將10ml40%氫氧化鈉溶液倒入小玻璃杯,提起玻璃塞使其緩慢流入反應室,立即將玻璃蓋塞緊,並加水於小玻璃杯以防漏氣。夾緊螺鏇夾,開始蒸餾,蒸氣通入反應室使氨通過冷凝管而進入接收瓶內,蒸餾5min。移動接收瓶,使冷凝管下端離開液皿,再蒸餾1min,然後用少量水沖洗冷凝管下端外部。取下接收瓶,以0.01N硫酸或0.01N鹽酸標準溶液定至灰色或藍紫色為終點。
同時吸取10.0ml試劑空白消化液按3操作。
計算
X=((V1-V2)*N*0.014)/(m*(10/100))+F*100
X:樣品中蛋白質的含量,g;
V1:樣品消耗硫酸或鹽酸標準液的體積,ml;
V2:試劑空白消耗硫酸或鹽酸標準溶液的體積,ml;
N:硫酸或鹽酸標準溶液的當量濃度;
0.014:1N硫酸或鹽酸標準溶液1ml相當於氮克數;
m:樣品的質量(體積),g(ml);
F:氮換算為蛋白質的係數。蛋白質中的氮含量一般為15~17.6%,按16%計算乘以6.25即為蛋白質,乳製品為6.38,麵粉為5.70,玉米、高粱為6.24,花生為5.46,米為5.95,大豆及其製品為5.71,肉與肉製品為6.25,大麥、小米、燕麥、裸麥為5.83,芝麻、向日葵為5.30。
注意事項
(1)樣品應是均勻的,固體樣品應預先研細混勻,液體樣品應振搖或攪拌均勻。
(2)樣品放入定氮瓶內時,不要沾附頸上,萬一沾附可用少量水衝下,以免被檢樣消化不完全,結果偏低。
(3)消化時如不容易呈透明溶液,可將定氮瓶放冷後,慢慢加入30%過氧化氫2-3ml,促使氧化。
(4)在整個消化過程中,不要用強火,保持和緩的沸騰,使火力集中在凱氏瓶底部,以免附在壁上的蛋白質在無硫酸存在的情況下。使氮有損失。
(5)如硫酸缺少,過多的硫酸鉀會引起氨的損失,這樣會形成硫酸氫鉀,而不與氨作用,因此當硫酸過多的被消耗或樣品中脂肪含量過高時,要增加硫酸的量。
(6)加入硫酸鉀的作用為增加溶液的沸點,硫酸銅為催化劑,硫酸銅在蒸餾時作鹼性反應的指示劑。
(7)混合指示劑在鹼性溶液中呈綠色,在中性溶液中呈灰色,在酸性溶液中呈紅色。如果沒有溴甲酚綠,可單獨使用0.1%甲基紅乙醇溶液。
(8)氨是否完全蒸餾出來,可用PH試紙試餾出液是否為鹼性。
(9)吸收葉也可以用0.01當量的酸代表硼酸,過剩的酸液用0.01N鹼液滴定,計算時,A為試劑空白消耗鹼液數,B為樣品消耗鹼液數,N為鹼液濃度,其餘均相同。
(10)以硼酸為氨的吸收液,可省去標定鹼液的操作,且硼酸的體積要求並不嚴格,亦可免去用移液管,操作比較簡便。
(11)向蒸餾瓶中加入濃鹼時,往往出現褐色沉澱物,這是由於分解促進鹼與加入的硫酸銅反應,生成氫氧化銅,經加熱後又分解生成氧化銅的沉澱。有時銅離子與氨作用,生成深l藍色的結合物[Cu(NH3)4]2+
(12)這種測算方法本質是測出氮的含量,再作蛋白質含量的估算。只有在被測物的組成是蛋白質時才能用此方法來估算蛋白質含量。