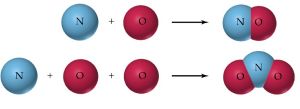
定義
例如銅和氧可以生成氧化銅和氧化亞銅兩種化合物。 在氧化銅中,含銅80%,含氧20%,銅與氧的質量比為4∶1。在氧化亞銅中,含銅88.9%,含氧11.1%,銅與氧的質量比為8∶1。由此可見,在這兩種銅的氧化物中, 與等量氧化合的銅的質量比為1∶2,是一個簡單的整數比。
歷史
19世紀初,J·道爾頓按原子概念推論,提出了倍比定律(Law of multiple proportions),並用實驗證明了這一定律,這是人們承認原子學說的重要依據。各元素總是按一定的質量比例相互化合,這是因為該化合物的分子總是由一定數目的一種元素的原子與一定數目的另一種元素的原子結合而成的,而各種元素的原子的質量是一定的。如果一種元素的一個原子不僅可以與另一種元素的一個原子化合形成一種化合物,而且也可以與另一種元素的兩個、三個原子形成幾種不同的化合物,由於第二種元素的原子量都是相同的,因此,與一定質量的第一種元素(例如一個原子)相化合的第二種元素的質量就成簡單的整數比,如1∶2,1∶3等。這一定律也為J·J·貝采利烏斯的實驗證實。
1800
1800年,戴維在一家實驗室測定了三種氮的氧化物的重量組成,即N20、NO、NO2。經過換算,此三種氣體中,與相同量的氮相結合氧重量比為1:2.2:4.1,即約為1:2:4。然而,可惜的是戴維並未進行此種換算。
1803年,道爾頓也曾分析過兩種碳的氧化物-CO、CO2,測定出兩種氣體中碳與氧的重量比分別為5.4:7和5.4:14。道爾頓注意到了兩種氧之重量比為1:2。在這一年,道爾頓以大氣的物理學研究為根據,正在思考其原子學說,同時他也根據其原子論觀點意識到他的學說本身就有倍比定律的含義。我們說,道爾頓的原子學說推理的一個必然結果就是倍比定律,同樣,他也更期待這一定律的確立,那樣,他的原子學說就多了一個有力的證明。因此,他也有意識地進行著倍比定律的研究。
1804
1804年,道爾頓又分析了沼氣,知道與同量碳相結合的氫的重量之比2:1。隨後,他明確地提出了倍比定律,並以此論證其原子學說。道爾頓指出,當相同的兩元素可以生成兩種或兩種以上的化合物時,如果其中一元素的重量恆定,那么另一元素在各化合物中的相對重量有簡單的倍數比。
在此之後,貝采里烏斯也做了許多與道爾頓類似的試驗,得來了許多較為精確的數據,其結果與道爾頓的結果基本相符,證實了倍比定律的正確性。這一工作,使道爾頓的倍比定律有了一塊堅實的基石。
在貝采里烏斯之後,1840年,斯達和杜馬對多種化合物中元素的相對質量之間進行了極為嚴格的測定,得出了與貝采里烏斯一樣的結果。這樣,倍比定律更加牢固,而原子學說也因此在相當長一段時間內無人質疑。