簡介
 氯水
氯水反應
在氯溶於水時,一部分氯與水反應,形成次氯酸和鹽酸。化學方程式:Cl2+H2O=HCl+HClO
Cl2+H2O=H+ +Cl- +HClO
HClO分子的結構式為H-O-Cl(氧處於中心)。
與液氯的區別
液氯和氯水是兩種不同的物質。液氯是Cl2在加壓或冷卻時變成的液態Cl2,是純淨物;而氯水是氯氣溶於水中形成的溶液,是混合物。
分類
一般可分為新制氯水和久制氯水:
新制氯水
成份:
Cl2(氯分子)(溶於水的Cl2分子)、HClO(次氯酸分子)(與水反應)、H2O(水分子);4種離子:Cl- (氯離子)(HCl電離)、H+ (氫離子)(HCl電離)、ClO- (次氯酸根離子)(HClO電離) OH- (氫氧根離子)(水電離出並且H+ 被奪去,極少數)
通常所說的氯水就是指新制氯水。
久制氯水
由於次氯酸的見光分解: 2HClO=2HCl+O2↑,基本上可以看成是鹽酸。
性質
 氯水
氯水物理性質
飽和氯水呈現黃綠色,具有刺激性氣味。
化學性質
由於含有多種物質,故其化學性質較複雜:
1、具氧化性,有漂白能力;
2、具有一定的酸性;
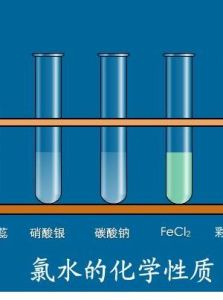
3、在氯水中加入硝酸銀溶液,有白色沉澱生成。
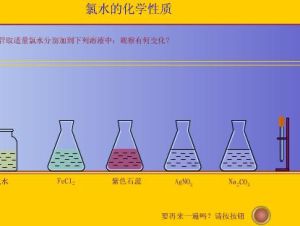
4、氯水可以使藍色石蕊試紙先變紅色(酸性)後褪色(漂白)。
製取
由將氯通入水中至飽和而得。
用途
1、新制氯水對細菌有殺傷力,可用來殺菌消毒;
2、久制氯水可以當作鹽酸使用;
3、由於氯水具有氧化性,可以使很多有機物褪色,用於漂白等。
保存方法
用棕色細口瓶放置在陰暗避光處。
其他
氯水的保存方法:用棕色細口瓶放置在陰暗避光處,且在其中加一些水。由於含有多種成份,故其性質較複雜:
氯水中的次氯酸對細菌有殺傷力,可用來殺菌消毒;
次氯酸具強氧化性,有漂白能力;
氯水具有一定的酸性;
在氯水中加入硝酸銀溶液,有白色沉澱生成。
氯水可以使藍色石蕊試紙先變紅色(酸性)後褪色(漂白)。
在碘化鉀澱粉試液中滴加幾滴氯水,現象是變藍,若在濃氯水中滴加碘化鉀澱粉試液,現象是先變藍後褪色,因為此時氯水過量直接將碘氧化成碘酸根。
需要注意的是:液氯和氯水是兩種不同的物質。液氯是Cl2在加壓或冷卻時變成的液態Cl2,是純淨物;而氯水是氯氣溶於水中形成的溶液,是混合物。
從氯水呈顯淡黃綠色,並具有氯氣的刺激性氣味,可以知道,氯水中存在著氯分子,說明氯氣並沒有完全跟水反應。這是因為在氯氣通入水中產生鹽酸和次氯酸的同時,溶液中的鹽酸跟次氯酸也發生反應,生成氯氣和水。也就是說,在氯水中同時存在著兩個化學反應,氯氣跟水的正反應和鹽酸跟次氯酸的逆反應。即這是一個可逆反應。
化學方程式可寫成:
Cl2+H2O=HCl+HClO
氯水中同時存在著單質氯、水、鹽酸和次氯酸四種成分。
氯水是氯氣溶於水所得的混合物。在氯水中存在如下三個平衡:
氯水工藝泵
Cl2+H2O=HCl+HClO①
HClO=H++ClO-(此電離可逆)
H2O=H++OH-③
所以在氯水中含有五種分子:Cl2、H2O、HClO、HCl及極少量O2;四種離子:H+、Cl-、及少量OH-和少量ClO-。
氯水如久置,其中各成分的相對含量將發生變化,這是氯水中存在著如下反應的結果:
Cl2+H2O<=可逆=>HCl+HClO(不穩定)
2HClO==光照==2HCl+O2↑
最後導致氯水的黃綠色顏色消失,pH減小,久置的氯水可視為鹽酸。