Tau蛋白異常
Tau蛋白異常磷酸化
Tau蛋白異常磷酸化 AD患者腦中Tau蛋白總量多於正常人,且正常Tau蛋白減少而異常過度磷酸化Tau蛋白大量增加。AD患者腦Tau蛋白異常過度磷酸化後與微管蛋白的結合力僅是正常Tau蛋白的1/10,也失去其促進微管裝配形成的生物學功能並喪失維持微管穩定的作用,PHF-Tau與微管蛋白競爭結合正常Tau蛋白及其它大分子微管相關蛋白,並從微管上奪取這些蛋白導致微管解聚,破壞正常的微管系統,異常磷酸化的Tau蛋白則自身聚集成PHF/NFT結構。AD患者腦中受累神經元微管結構廣泛破壞,正常軸突轉運受損,引起突觸丟失神經元功能損傷,發生腦神經退行性病變。AD患者腦中發現三種Tau蛋白,即胞漿正常Tau蛋白(C-Tau),可溶於水的異常磷酸化Tau蛋白(AD p-Tau)以及異常修飾聚集成PHF的Tau蛋白(PHF-Tau),它存在泛素蛋白修飾。
①蛋白磷酸酯酶與Tau蛋白磷酸化 內源性磷酸酯酶促進Tau蛋白脫去磷酸基,哺乳動物的絲氨酸/蘇氨酸磷酸酯酶PP-2A、PP-2B在限制AD患者腦Tau蛋白異常過度磷酸化方面起關鍵作用。用磷酸酯酶PP-1、PP2A的抑制劑可引起大鼠海馬神經元突觸和樹突丟失,伴有Tau蛋白的過度磷酸化。研究證明,AD患者腦中磷酸酯酶PP-2A、PP-2B、PP-1活性均低於正常老人。還發現PHF-Tau有抵抗磷酸酯酶的作用。現在認為AD患者大腦磷酸酯酶活性缺陷可能是引起Tau蛋白異常過度磷酸化的主要原因。用PP-2A、PP-2B或PP-1使AD p-Tau脫磷酸基可一定程度恢復Tau蛋白促進微管組裝作用。
②蛋白激酶與Tau蛋白磷酸化 體外促進Tau蛋白發生磷酸化的蛋白激酶有多種,AD發生時可能有幾種蛋白激酶參與Tau蛋白的異常過度磷酸化。但不能肯定蛋白激酶活性在AD腦中顯著增強。
Tau蛋白異常糖基化
在AD腦中過度磷酸化的AD P-Tau或PHF-Tau還存在與糖分子有關的異常修飾。即由特異糖基轉移酶催化糖基連線於Tau蛋白,該糖基可被特異糖苷酶水解除去;另外,Tau蛋白分子富含的賴氨酸被細胞內糖分子不可逆非酶促修飾,產生不溶性抗酶解的交連體分子(AGFs)。Tau蛋白的兩種修飾相互影響。Tau蛋白的異常磷酸化修飾與PHF/NFT的形成和維持其穩定性有關;而糖基化修飾作用是維持PHF/NFT的周期性螺旋結構的穩定。在Tau蛋白過度磷酸化後結構性質改變更易發生糖基化修飾,兩種修飾相互作用促進PHF/NFT結構最終形成。Tau蛋白的糖基化導致分子間廣泛交連,可引起氧自由基產生的氧應激,後者促進β-AP釋放及細胞因子表達增加。
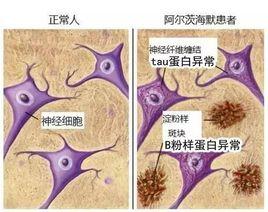
Tau蛋白與AD
AD(Alzhemier Disease)是德國醫生阿爾茨海默最先發現的一種腦神經疾病。它的主要症狀有兩個:一是 β-澱粉樣蛋白在神經元細胞外異常沉積形成的老年斑,二是tau蛋白的異常磷酸化所形成的NFTs(神經元纖維纏結 )。最近有研究表明相比β-澱粉樣蛋白的異常沉積,tau蛋白的異常磷酸化所導致的聚集同AD的相關性更高。AD患者腦中存在大量異常Tau蛋白。Tau蛋白異常修飾、含量變化對臨床AD病理髮生有重要作用。
血漿、腦脊液Tau蛋白水平分析
AD患者血漿、腦脊液(CSF)中Tau蛋白測定可用酶聯免疫吸附法(ELISA),研究表明AD患者CSF中Tau蛋白水平比同齡正常及非神經疾病患者組均顯著增高。用CSF中Tau蛋白含量增高診斷AD,其敏感性為82%,特異性達70%。如同時測出CSF中Tau蛋白水平增加及β-AP42水平降低,對AD診斷的特異性可達70%~90%。
抑制Tau蛋白特異修飾作用
由於Tau蛋白的異常修飾涉及多種酶,可在此基礎上發展新的治療AD藥物。套用磷酸酯酶及該酶激活劑類藥物,降低Tau蛋白磷酸化過程,可能對AD患者的神經元纖維退化有抑制甚至逆轉的作用。也可考慮用分解糖基的特異糖苷酶,限制Tau蛋白的異常糖基化。