組成
pH計(見圖)組成的基本環節是檢測池和顯示裝置。檢測池是pH計的核心。它是由一對電極(參比電極和測量電級)同時插入待測溶液中構成的一個化學原電池。常用的參比電極是甘汞電極,測量電極是玻璃電極,前者的電極電位固定不變,不因待測溶液的pH值不同而異。後者的電極電位則因待測溶液的pH值不同而發生變化,兩者之間具有一定的函式關係(用涅侖斯特公式表示)。
因此,由一對電極構成的化學原電池的輸出電動勢會因待測溶液的pH值不同而異。通過測量原電池的輸出電動勢就可以求得溶液的pH值,並由顯示儀表直接顯示出來。
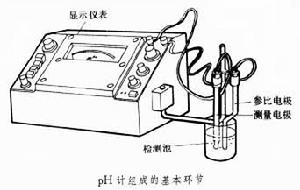 pH 計
pH 計原理
 |
| pH 計 |
“pH”是一個符號,用以表示溶液中氫離子濃度。它與氫離子濃度之間的關係為
pH=-log[H+]式中[H+]是以克分子濃度(M)為單位的氫離子濃度。如果[H+]=10-7M,則pH=7,溶液為中性。[H+]>10-7M,則pH<7,溶液為酸性。[H+]<10-7M,則pH>7,溶液為鹼性。
溶液pH值的範圍是0~14,具體pH計的測量和顯示量程可以在0~14之間取某一段。
套用

實驗室台式PH計
 台式PH計pH計的套用範圍很廣,凡是需要監測溶液酸鹼度的生產過程和科學實驗都少不了它,特別是在化工、石油和冶金等部門套用尤為廣泛。
台式PH計pH計的套用範圍很廣,凡是需要監測溶液酸鹼度的生產過程和科學實驗都少不了它,特別是在化工、石油和冶金等部門套用尤為廣泛。
