不可溶性鹼
能與酸反應
例如:
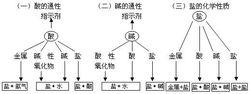 鹼的通性
鹼的通性(1) Cu(OH)2+2HCI=CuCl2+2H2O
(2) Mg(OH)2+2HCI=MgCI2+2H2O
可溶性鹼通性
鹼溶液呈鹼性PH>7
(水溶液,25攝氏度)
鹼能使紫色石蕊試液變藍
鹼能使無色的酚酞試劑變紅。
鹼與酸鹼指示劑的反應屬於化學反應。
鹼 +酸性氧化物==鹽 + 水
舉例:
①Ca(OH)+CO=CaCO↓+HO
②2NaOH+CO=NaCO+HO
註:酸性氧化物不等於非金屬氧化物,但在國中化學教學中一般認為是非金屬氧化物。
(1)概念:能與鹼反應生成鹽和水的氧化物(通常不涉及化合價改變的前提下)。如CO、SO、SiO、SO、MnO等均屬於酸性氧化物。
(2)注意:
①酸性氧化物包括大多數非金屬氧化物和少數金屬氧化物(如MnO),但少數非金屬氧化物不是酸性氧化物,如CO、HO等中性氧化物。
②酸性氧化物在正常條件下多數能溶於水,跟水化合生成酸,但這一點並不是酸性氧化物必然的通性,如SiO就不能與水在普通條件下反應。
鹼+酸==鹽+水(中和反應)
(一般來說,中和反應都是放熱反應且中和反應是複分解反應)
舉例:
①2NaOH+HSO=NaSO+2HO
②Ca(OH)+2HNO=Ca(NO)+2HO
鹼 +鹽==新鹽 + 新鹼
舉例:
①Ca(OH)+NaCO=CaCO↓+2NaOH
②Ba(OH)+NaCO=BaCO↓+2NaOH
條件:
①滿足複分解反應的條件(生成物中有沉澱、氣體生成或水)
②反應物必須可溶於水
不溶性鹼=加熱+金屬氧化物+水
舉例:
Cu(OH)≜CuO+HO
即使滿足複分解反應的條件,卻不是屬於鹼與鹽的反應,因為CaCO3不溶於水。
