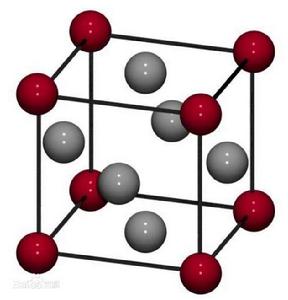
定義
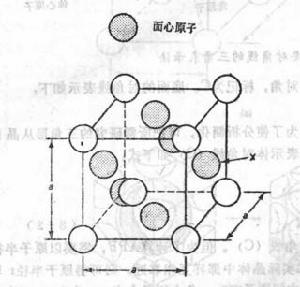 面心立方體
面心立方體面心立方體,每個面上都有一個原子。FCC系統的晶胞如圖所示。 這種結構除頂角上有原子外,在晶胞六個面的中心處還有6個原子,故稱為面心立方。
相關概念
面心立方晶格
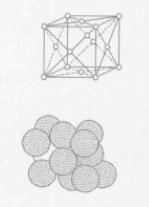 面心立方體
面心立方體如圖,原子分布在立方體的各結點和各面的中心處,角上結點的原子為8個晶胞所共有,面上的原子為2個晶胞所共有,因此,屬於每個晶胞的子數應為4個,屬於面心立方品格的金屬有銅、鋁、鎳、金、銀、r鐵等,大多數金屬在形成固體後只有一種晶體結構,但少數金屬在不同溫度時它的晶體結構不同,純鐵在1390℃-910℃時稱為r鐵,屬於面心立方晶格,屬面心立方晶格的金屬塑性都非常好。
體心立方晶格
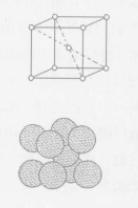 面心立方體
面心立方體如圖,在晶胞的角上和中心處各有1個原子,角上的原子為8個品胞所共有,中心處的原子為晶胞所獨占,所以每個品胞的原子數數為1/8×8+1=2個,屬於體心立方品格的金屬有絡、鉬、鎢、釩、鈮、a鐵等(當純鐵在1390℃-1539℃之間和910℃以下時叫a鐵,是體心立方品格),體心立方晶格的金屬一般都有較高的熔點、相當大的強度和較好的塑性。
密排六方晶格
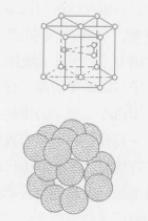 面心立方體
面心立方體如圖,晶胞是6方柱體形狀,6方柱體的12個角上結點各有1個原子,頂面、底面的中心各有1個原子,晶胞體內對稱的位置有3個原子,屬於每個晶胞的原子數為1/6x12+3+1/2×2=6個。屬於密排六方晶格的金屬有鎘、鋅、鎂、鑽、B鉻等。它們的特點是塑性差。晶體結構是密排六方體系。“密排”這一名稱就顯示這種晶體結構是種高密度的原子堆積排列,類似fcc。這一晶系與fcc排列不同之處在於它的第三層原子直接在第一層之上。
發展歷史
1998年,Jarkov等在分析多晶體電子行射圖譜的基礎上,認為新金剛石是面心立方結構,其晶格常數為3.57A。2001年,Konyashin等人通過電子衍射、電子能量損失譜(EEIS)和半經驗的能量計算認定新金剛石為面心立方結構的純碳,其晶格常數為3.563A。 Konyashin的半經驗計算結果認為。面心立方結構的碳在晶格常數為3.68A時存在能量的局部最小值。也就是面心立方結構的碳是亞穩相 。
然而,最近的第一性原理計算卻引起了對fcc碳穩定性的爭論。 Pickard等人更精確的第一性原理的能量計算結果表明,fcc碳的晶格常數應該為3.08A,也就是說晶格常數為3.57A左右的fcc純碳並不是真正的亞穩相。 Murrieta等人的第一性原理的能量計算結果也進一步證實了Pickard的計算結果。 Murrieta認為,晶格常數約為3.57A的fcc碳能夠穩定存在的原因可能是由於襯底的作用和夾雜的原因,然而,真正的fcc碳的穩定性的原因還需要繼續的實驗和理論的研究。顯然,,Konyashin的半經驗能最計算結果過高地估計了fcc碳的晶格常數和穩定性。