基本概念
基本定義
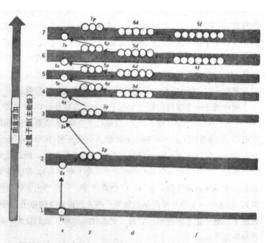
電子構型是指:電子依照能量高低的能級進行排列,其一般順序為:ls,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d
電子排布式定義
電子排布式則是指:電子依照能層的順序進行排列,其一般順序為:
1s,2s,2p,3s,3p,3d,4s,4p,4d,4f...
不相容原理
每個軌道上最多容納一個自鏇平行的電子。根據能量最低原理,電子傾向於先占有能量最低的軌道。又根據洪德規則,能量相等的軌道上若自鏇平行的電子數最多時整個體系的能量最低。根據這三個原理向軌道填入電子,得到的原子總能量最低,即基態原子。例如鋁原子核外,當其1s、2s、2p、3s和3p軌道上分別填入2個、2個、6個、2個和1個電子時,為鋁原子基態,因此鋁原子基態的電子構型為1s 2s 2p 3s 3p 。實際上除最外層(n=3的軌道)之外,它完全與元素周期表上前一周期末的惰性氣體氖的電子構型1s 2s 2p 相同,所以鋁原子基態的電子構型又可簡單記為【Ne】3s 3p 。正三價鋁離子(Al )的電子構型與氖原子相同。
原子的電子構型
原子中每個電子的能量是由他所處的軌道高度(能級)以及主量子數n和角量子數l來代表;(量子數是量子力學中表述原子核外電子運動的一組整數或半整數。因為核外電子運動狀態的變化不是連續的,而量子數是量子化的,所以量子數的取值也不是連續的,而只能取一組整數或半整數;量子數包括主量子數n、角量子數l、磁量子數m和自鏇量子數ms四種,前三種是在數學解析薛丁格方程過程中引出的,而最後一種則是為了表述電子的自鏇運動提出的。)n是整數。通常把n相同的軌道稱為屬於同一殼層。從距離核最近的殼層向外數,把殼層依次編號為:1、2、3、4、5、6、7、…,分別用符號K、L、M、N、O、P、Q、…表示。n越小,離核愈近,殼層上的電子的能量愈低。屬於同一主量子數n的電子,其軌道角動量可以是0、1、2、…、(n-1),分別用角量子數l等於 0、1、2、…、(n-1)表示,記為s、p、d、f、g、…。例如同屬於n=3,l=0、1和2的軌道,分別稱為3s、3p和3d軌道。l愈小表示電子軌道運動的能量愈小。角量子數為 l的軌道內含有2(2l+1)個軌道。所以s、p、d和f軌道內分別含有2、6、10和14個軌道。由此推算:主量子數為n的殼層中軌道的總數為:
即n=1、2、3、4…的殼層內分別含有 2、8、18、32、…個軌道。因此,原子體系的狀態可以用其中全體N個電子的量子數n和l的集合(n1l1、n2l2、…、nNlN)來表示,這個集合就稱為原子的電子構型。
原子中軌道:
ls<2s<2p<3s<3p<4s<3d<4p<5s<4d
<5p<6s<4f<5d<6p<7s<5f<6d…ns<(n-3)g<(n-2)f<(n-1)d<np
分子的電子構型
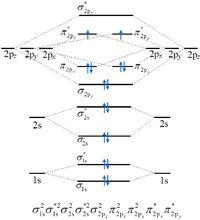 O2的分子軌道電子排布
O2的分子軌道電子排布分子體系的電子狀態也可以用全體電子所處的單電子軌道的總體來表示。以異核雙原子分子NO為例:分子軌道按照它在分子軸向上沒有節面、有一個節面或有二個節面而分別稱為σ、π或δ分子軌道。各類分子軌道內,按能量次序由低向高排列編號(如1σ、2σ、3σ、4σ…,和1π、2π、3π…)。每個σ分子軌道內含有2個電子,π分子軌道內有4個電子……再按照上述的泡利不相容原理、能量最低原理和洪特原則,將原先氮原子的7個電子和氧原子的8個電子(共15電子)填入分子軌道,並且按分子軌道的能量次序由低向高寫出:
(1σ)2(2σ)2(3σ)2(4σ)2(1π)4(5σ)2(2π)1
這就是NO分子的電子構型。實際上分子軌道1σ和2σ上的電子仍在原有的原子核周圍,本質還是氮原子和氧原子上的K層(n=1)電子,故NO分子的電子構型又可
配合物的電子構型
配合物的電子構型指中心原子的價電子數。
例:IrCl[P(CH)]中的Ir是16電子的構型,而IrCl[P(CH)]中的Ir是18電子的構型。
寫為KK(3σ)2(4σ)2(1π)4(5σ)2(2π)1。
外圍電子層排布
(括弧指可能的電子層排布)
1.H 1s
2 .He 1s
3 .Li 2s
4 .Be 2s
5 .B 2s 2p
6 .C 2s 2p
7 .N 2s 2p
8 .O2s 2p 一些元素的電子構型
9 .F 2s 2p
10. Ne 2s 2p
11 .Na 3s
12 .Mg 3s
13 .Al 3s 3p
14 .Si 3s 3p
15 .P 3s 3p
16 .S 3s 3p
17 .Cl 3s 3p
18 .Ar 3s 3p
19 .K 4s
20 .Ca 4s
21 .Sc 3d 4s
22 .Ti 3d 4s
23 .V 3d 4s
24 .Cr 3d 4s
25 .Mn 3d 4s
26 .Fe 3d 4s
27 .Co 3d 4s
28 .Ni 3d 4s
29 .Cu 3d 4s
30 .Zn 3d 4s
31 .Ga 4s 4p
32 .Ge 4s 4p
33 .As 4s 4p
34 .Se 4s 4p
35 .Br 4s 4p
36 .Kr 4s 4p
37 .Rb 5s
38 .Sr 5s
39 .Y 4d 5s
40 .Zr 4d 5s
41 .Nb 4d 5s
42 .Mo 4d 5s
43 .Tc 4d 5s
44 .Ru 4d 5s
45 .Rh 4d 5s
46 .Pd 4d
47 .Ag 4d 5s
48 .Cd 4d 5s
49 .In 5s 5p
50 .Sn 5s 5p
51 .Sb 5s 5p
52 .Te 5s 5p
53 .I 5s 5p
54 .Xe 5s 5p
55 .Cs 6s
56 .Ba 6s
57 .La 5d 6s
58 .Ce 4f 5d 6s
59 .Pr 4f 6s
60 .Nd 4f 6s
61 .Pm 4f 6s
62 .Sm 4f 6s
63 .Eu 4f 6s
64 .Gd 4f 5d 6s
65 .Tb 4f 6s
66 .Dy 4f 6s
67 .Ho 4f 6s
68 .Er 4f 6s
69 .Tm 4f 6s
70 .Yb 4f 6s
71 .Lu 4f 5d 6s
72 .Hf 5d 6s
73 .Ta 5d 6s
74 .W 5d 6s
75 .Re 5d 6s
76 .Os 5d 6s
77 .Ir 5d 6s
78 .Pt 5d 6s
79 .Au 5d 6s
80 .Hg 5d 6s
81 .Tl 6s 6p
82 .Pb 6s 6p
83 .Bi 6s 6p
84 .Po 6s 6p
85 .At 6s 6p
86 .Rn 6s 6p
87 .Fr 7s
88 .Ra 7s
89 .Ac 6d 7s
90 .Th 6d 7s
91 .Pa 5f 6d 7s
92 .U 5f 6d 7s
93 .Np 5f 6d 7s
94 .Pu 5f 7s
95 .Am 5f 7s
96 .Cm 5f 6d 7s
97 .Bk 5f 7s
98 .Cf 5f 7s
99 .Es 5f 7s
100. Fm 5f 7s
101 .Md (5f 7s )
102 .No (7s )
103 .Lr (6d 7s )
104 .Rf (6d 7s )
105 .Db (6d 7s )
106 .Sg 6d 7s
107 .Bh 6d 7s
108 .Hs 6d 7s
109 .Mt 6d 7s
110 .Ds 6d 7s
111 .Rg7s
112 .Cn 7s
113 .Uut 7p
114 .Uuq 7p
115 .Uup 7p
116 .Uuh 7p
117 .Uus 7p
118 .Uuo 7p
119 .Uue 7p 8s
 一些元素的電子構型
一些元素的電子構型