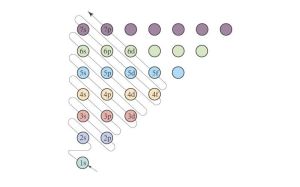
原理
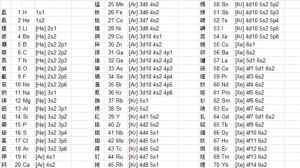 電子排布式
電子排布式舉例
如碳、氧、鈉、鈣原子的電子排布式分別是1s22s22p2、1s22s22p4、1s22s22p63s1、1s22s22p63s23p64s2,其簡化的電子排布式可以分別表示為[He]2s22p2、[He]2s22p4、[Ne]3s1、[Ar]4s2。
原子實:
[He]:1s2
[Ne]:1s2、2s2、2p6
[Ar]:1s2、2s2、2p6、3s2、3p6
[Kr]:1s2、2s2、2p6、3s2、3p6、3d10、4s2、4p6
[Xe]:1s2、2s2、2p6、3s2、3p6、3d10、4s2、4p6、4d10、5s2、5p6
[Rn]:1s2、2s2、2p6、3s2、3p6、3d10、4s2、4p6、4d10、5s2、5p6、4f145d10、6s2、6p6
[Uuo]:1s2、2s2、2p6、3s2、3p6、3d10、4s2、4p6、4d10、5s2、5p6、4f145d10、5f14、6s2、6p6、6d10、7s2、7p6。