定義
在化學反應中,一般是原子的最外層電子數發生變化。為了簡便起見,化學中常在元素符號周圍用小黑點“.”或小叉“×”來表示元素原子的最外層電子,相應的式子叫做電子式。用電子式可以表示原子、離子、單質分子,也可表示共價化合物、離子化合物及其形成過程。書寫電子式應該注意:
1. 無論何種微粒,其電子式都是由原子為基本單位組成的,不能出現角碼甚至係數。
2. 組成各種微粒的各個原子的電子式,必須力求均勻、對稱。穩定的8電子結構通常表 示為四對電子(一般為元素符號的上、下、左、右各一對電子.)。
3. 中學所學習的經典的8隅體的電子式屬於過時的理論,只能用於表示很少一部分由主族元素形成的物質,不能表示由過渡元素形成的物質。
如下列比較常見的化學物質,電子式完全不能解釋:
O2(兩個三中心π鍵);臭氧(三中心四電子π鍵);超氧化物(三電子π鍵);臭氧化物(三中心五電子π鍵);二氧化碳,一氧化二氮,疊氮根N3-(三中心四電子π鍵);一氧化氮(三電子π鍵);二氧化氮(三中心四電子π鍵);三氧化硫,碳酸根,硝酸根(四中心六電子π鍵);二氧化氯(三中心五電子π鍵);硝酸(三中心四電子π鍵);一氧化碳(配位π鍵)。
所以我們才說電子式局限性較大,只能表述一小部分物質的結構。

原子
依據元素的原子最外層電子個數的多少,先用小黑點“·”(或“×”)等符號在元素符號上、下、左、右各表示出1個電子,多餘的電子配對。(因為鎂的電子成對出現,下圖中鎂的電子式錯誤)例如:
離子
1. 陽離子:簡單陽離子由於在形成過程中已失去最外層電子,所以其電子式就是其離子符號本身。例如:Na+ K+ Mg2+ Ca2+ Ba2+ Al3+複雜的陽離子(例如NH4+、H3O+等.) 除應標出共用電子對、非共用電子對等外,還應加中括弧,並在括弧的右上方標出離子所帶的電荷。

原子失去電子變成陽離子,原子得到電子變成陰離子。原子中,質子數=核電荷數=核外電子數

共價型單質分子
必須正確地表示出共用電子對數,並滿足每個原子的穩定結構。(請注意下圖中He的結構完全錯誤,應該改為左右各只有一點才正確)例如:
共價化合物
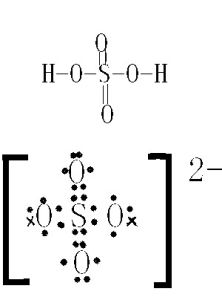
共價化合物電子式的書寫,基本與共價型單質分子相同,一般為正價者在前。對於不同價態的元素的原子,一般將化合價絕對值大的寫在中間,絕對值小的寫在周邊。例如:
離子化合物
離子化合物電子式的書寫,是將陰陽離子(陽離子在前,陰離子在後.)拼在一起。對於不同價態的離子,也按其絕對值,遵照“大值在中間、小值在周邊”的原則書寫。例如:
用電子式表示化合物的形成過程
1. 共價化合物:
共價鍵的概念為原子間通過共用電子對而形成的化學鍵。由共價鍵形成的化合物是共價化合物。共價化合物中原子間全部是共價鍵。
2. 離子化合物:
離子鍵的概念為陰、陽離子通過靜電作用形成的化學鍵。以離子鍵結合的化合物叫離子化合物。
3.特殊情況
NaOH 屬於例外,在它的化學式中,既包含了離子鍵也包含了共價鍵。但是由於其含有離子鍵,所以我們稱像NaOH一類的兩種鍵都包含的物質為離子化合物這裡我們需要注意,CO2屬於不能用電子式解釋的化合物(存在大派鍵),中學對於CO2結構的描述完全錯誤。因為實驗證明,二氧化碳中C-O鍵鍵長介於一氧化碳(典型的三鍵)與羰基(雙鍵)之間,這是電子是所不能解釋的。下面是對二氧化碳結構的正確描述:在CO2分子中,碳原子採用sp雜化軌道與氧原子成鍵。C原子的兩個sp雜化軌道分別與兩個O原子生成兩個σ鍵。C原子上兩個未參加雜化的p軌道與sp雜化軌道成直角,並且從側面同氧原子的p軌道分別肩並肩地發生重疊,生成兩個∏三中心四電子的離域鍵。因此,縮短了碳—氧原子間地距離,使CO2中碳氧鍵具有一定程度的叄鍵特徵。
CO2的正確結構: