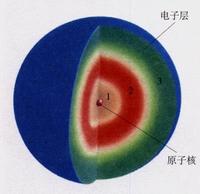
 電子層
電子層E1s<E2s<E2p<E3s<E3p<E4s<E3d<E4p<E5s<E4d<E5p<E6s<E4f<E5d;規則E:np>(n-1)d>(n-2)f>ns根據這個排電子所在的原子軌道離核越近,電子受原子核吸收力越大,電子的能量越低。反之,離核越遠的軌道,電子的能量越高,這說明電子在不同的原子軌道上運動時其能量可能有所不同。原子中電子所處的不同能量狀態稱原子軌道的能級。根據原子軌道能級的相對高低,可劃分為若干個電子層,K、L、M、N、O、P、Q…. 同一電子層又可以劃分為若干個電子亞層,如s、p、d、f等。每個電子亞層包含若干個原子軌道。原子軌道的能級可以通過光譜實驗確定,也可以套用薛丁格方程求得 電子層
原子軌道的能級與其所在電子的電子層及電子亞層有關,還與原子序數有關。E1s<E2s<E2p<E3s<E3p<E4s<E3d<E4p<E5s<E4d<E5p<E6s<E4f<E5d;規則E:np>(n-1)d>(n-2)f>ns;1、不同電子層能級相對高低K<L<M<N…2、同一電子層不同亞層:ns<np<nd<nf…3、同一亞層內各原子軌道能級相同,稱為簡併軌道。4、原子軌道能級隨原子序數增大而降低。電子軌道亞層在周期表上也有,就是那個S、P、D、F、G等就是亞層排布。S亞層最多容納兩個電子,P層最多6個,依次為10個、14個。另外在分析時候還要考慮能級交錯。給你舉個例子,鐵的亞層在書上標的是3D64S2,這就是說,鐵的第四層只用到s層,有兩個電子,而第三層用到D層,D層有六個,這說明第三層的S、P層都飽和,所以S層有2個,P層有6個,D層有6個(上面分析的)所以鐵的第三層有2+6+6=14個電子。先說說金屬。元素周期表的前兩個族除了氫之外都是金屬元素。由於它們是主族元素,它們的原子核外的電子層里電子都是飽和的,除了最外層。這樣看,它們最外層的電子很容易全部失去,因此它們的正價很穩定,而且只有一個,等於最外層的電子數。除了前兩個族的元素大部分為金屬元素外,還有過渡元素。
 電子-內部結構模型圖
電子-內部結構模型圖從過渡元素在周期表中的位置看,很容易判斷它們的次外層電子並不飽和,這樣使得它們的化合價繁多,性質也很複雜。通常過渡元素都有亞正價,比如說鐵的二價正離子就叫亞鐵離子,銅的一價正離子就叫亞銅離子。這些亞價的正離子都不是很穩定,在有氧化劑的存在下都會被氧化,成為高價金屬離子。而且這些過渡元素幾乎都可以成為酸根的主元素 ,比如鐵酸根、錳酸根和高錳酸根等。在這種高價態過渡元素形成的酸中,由於過渡金屬最外層和次外層的電子全部失去,這些酸大部分都有強氧化性,比如重鉻酸、高錳酸等。在化學推斷題中,經常使用這些課本中不常見的氧化劑,多了解它們的性質對今後做題很有幫助。在第三主族到第六主族裡都有金屬元素存在,它們是因為隨著質子數增多,都顯示了或多或少的金屬性。在元素周期表中非金屬元素都是寫在綠框裡的,很醒目。非金屬元素都一得電子,一般在與金屬元素形成的化合物中顯負價。但這不代表它們不顯正價。在遇到極強的氧化劑時,也會顯正價,比如七氧化二氯。這些正價的氧化物溶於水也會形成相應的酸。這些以高價非金屬元素為主元素的酸一般也都有強氧化性,如氯酸、濃硫酸。但是,由於氟的非金屬性最強,沒有氧化劑可以把它氧化,所以氟沒有正價。請注意在金屬與非金屬交界的地方,有一些元素,它們呈梯形排列,有鋁鍺銻和硼矽砷碲。它們兼有金屬性和非金屬性。這是由它們所在的特殊位置決定的。它們正處在金屬與非金屬交界處,是元素由金屬向非金屬過渡的中間元素。仔細觀察鑭系和錒系元素。這些元素之所以被排在周期表的同一個格里,是因為它們的性質很相似。它們最外層電子層電子數相同,電子的變化都發生在次外層或倒數第三層。科學家們為了周期。
電子層能量如果沒有外界能量輸入的話,電子會儘可能降低自身能量。能量低的電子在離核較近的區域運動,能量高的電子在離核較遠的區域運動。而電子總是儘先排布在能量最低的電子層里。也就是說,在通常情況下,低層有了空位,高層的電子會釋放光子降低能量填補到低層去(在外面跑大圈是很累的)。
