基本原理
電池是電化學的起源。而電化學分析法源自於電池構想,主要由正、負電極(electrodes)及適當的電解質(electrolyte)所組成。然而為達量度的關係,需在正負兩相電極間,選定一個可以推定出其他電極電位的標準電極。經統一下,以氫電極作為標準電極:氫氣壓力為一大氣壓,氫離子活性為1時,此電極於任一溫度皆為零。
然而,在電化學分析上,我們所需要的非如標準電位為零的氫電極,主因於氫氣並非容易控制,且不易定性,(圖一)故選用適當的參考電極作為基準點是必須的。而之前所謂的正、負電極,則可分為工作電極及輔助電極,其分法為:當工作電極為正極時,輔助電極為負極;當工作電極為負極時,輔助電極為正極。而電解質的選擇及濃度上也因與電極相配合才能達到最佳的傳輸效率。而籍由含欲測物質的電池,量度電池的相關性質,如電壓、電流、電導等作為定性定量的關係。而相關的電分析方法分類及量度性質如(表一)所示
一個電池反應,選擇電極及電解液是重要關鍵。能斯特方程式(Nernstequation)提供一理論且實際方法。
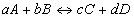 公式1
公式1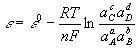 公式2
公式2其中,0為電池的標準電動勢,R為氣體常數,F為法拉第常數,n為反應中電子傳遞數,aA及aB為反應物活性,aC及aD為生成物活性。
一般電池,以具雙電極(正、負電極)及一電解液。然而,對於電分析法而言,選擇一個適當的參考電極是必須的,他除了與電解液具相關性外,其電位必須能提供合理的參考電位。而能斯特定律可得到較佳的電位視窗,(圖二),顯示出在電極為碳、汞和碳三電極在不同狀態的電解液的電位視窗:
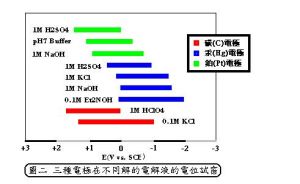 圖2
圖2