簡介
電位-pH圖,也稱 電勢-pH圖、 穩定區圖、 普爾貝圖,是表示系統的電極電勢與pH關係的圖,它在電化學中有很重要的意義。最早由比利時學者馬塞爾·普爾貝(Marcel Pourbaix)等人在20世紀30年代使用,用於金屬腐蝕問題,後套用範圍逐漸擴大到電化學、分析、無機、地質科學等領域,有很強的實用性。它相當於研究相平衡時的相圖,是一種電化學的平衡圖。最簡單的電位-pH圖只涉及一種元素的不同氧化態形態與水構成的體系,用它可以預測在具特定電位(氧還態)和pH(酸度)的水溶液體系中,某種元素穩定存在的形態和條件。
電位-pH圖的構建
電位-pH圖的構建比較複雜,一般包括以下三步:
列出有關物質的各種存在狀態及其化學勢值;
寫出相關物質之間反應的平衡關係式;
畫出各類反應的電位-pH圖,最後匯總。
1.列出有關物質的各種存在狀態及其化學勢值;
2.寫出相關物質之間反應的平衡關係式;
3.畫出各類反應的電位-pH圖,最後匯總。
標準電極電勢
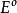 電位-pH圖
電位-pH圖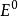 電位-pH圖
電位-pH圖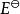 電位-pH圖
電位-pH圖 電位-pH圖
電位-pH圖標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也就是標準態時的電極電勢,記作、或,上標表示標準態。標準狀態意味著:溶質的有效濃度為1mol/L,氣體壓強為100 kPa,溫度一般為298K。
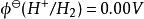 電位-pH圖
電位-pH圖雖然電池的電動勢可以直接測定,但單一可逆電極的標準電極電勢卻只有相對值沒有絕對值,而且它隨著溫度、濃度和壓強而發生變化。電極電勢的基準是標準氫電極:標準狀態下H /H電極的電勢被定為0.00V,即,其他電極電勢的值在此基礎上獲得。當某半電池和標準氫電池電極相連時為負極,該半電池的半反應的標準電極電勢為負值,且絕對值與電池電動勢相等;若為正極則相反。這樣求得的值稱作還原電勢,總反應的標準電極電勢也就是兩個半反應標準電極電勢的差,E 大於零時反應自發。
參看
•氧化物自由能圖
•元素電勢圖
•自由能-氧化數圖
