簡介
1916年。德國化學家科塞爾(W.Kossel)提出離子鍵理論,認為由原子得失電子後。生成的正、負離子之問靠靜電作用而形成的化學鍵。即離子鍵的本質是正、負離子之問的靜電引力。離子鍵可存在於氣體分子內,但大量存在於離子晶體中。
當元素的電負性差值越大時,越易形成離子化合物。但近代實驗表明,純粹的離子鍵是不存在的,絕大多數離子鍵都不是典型的,只是離子性占優勢而已。當兩元素電負性的差值△7>1.7時,單鍵離子鍵的成分(百分數)大於50%。這是一個有用的參考數據,當△y>1.7時,可認為形成離子型化合物。如NaCI,△x=3.16-0.93=2.23,可認為是典型的離子型化合物。
由於離子電場具有球形對稱性,陰、陽離子之間的靜電引力與方向無關,離子在其任何方向上均可與相反電荷的離子相互吸引而形成離子鍵,因此離子鍵無方向性。當兩個異電荷離子彼此吸引形成離子型分子後,由於離子的電場無方向性,各自仍具有吸引異電荷離子的能力,只要空間條件許可,每種離子均可結合更多的異電荷離子,因此離子鍵無飽和性。
正、負離子靠靜電吸引相互接近形成晶體,由離子鍵形成的化合物稱為離子型化合物,如鹼金屬的鹵化物和氧化物、鹼土金屬氧化物是典型的離子型化合物。
離子鍵的形成
離子鍵的形成離子鍵理論的主要論點如下:
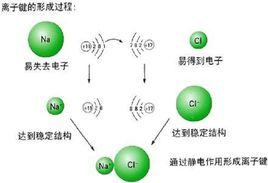
(1)當活潑金屬原子和活潑非金屬原子在一定條件下相遇時,由於雙方原子的電負性相差較大,金屬原子可能失去價電子,非金屬原子可能得到電子,從而發生原子間的電子轉移。電子轉移的結果,金屬原子成為帶正電荷的正離子,非金屬原子則變成帶負電荷的負離子。
(2)正負離子之間由於靜電作用而相互吸引,當它們充分接近時,兩核之間和電子云之間便產生排斥力。當吸引力和排斥力處於平衡狀態時,整個體系的能量降低到最低值,於是正負離子間就形成了穩定的化學鍵,即離子鍵。
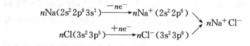
離子鍵的形成過程可用金屬鈉暴露在氯氣中形成氯化鈉的例子說明。
 離子鍵形成過程
離子鍵形成過程生成離子鍵的條件是原子間的電負性相差較大,一般要大於1.7左右。通過離子鍵形成的化合物叫作離子型化合物,如KCl、CsCl、MgO、CaO等。在一般情況下,離子型化合物具有較高的熔點和沸點,在熔融狀態或溶於水後均能導電。
離子鍵的本質
離子鍵本質上是靜電作用力,因此當離子電荷越高,離子間的核間距越小,離子間的吸引就越強,離子鍵也就越穩定。離子鍵是活潑金屬元素的原子和活潑非金屬元素的原子之間形成的,其形成的重要條件就是成鍵原子之間的電負性差值較大。一般來說,元素的電負性差越大,形成的離子鍵越強。在周期表中,IA族的鹼金屬電負性較小,ⅦA族的鹵素電負性較大,它們的原子之間形成的化學鍵一般都是離子鍵。如銫的電負性為0.79,而氟的電負性為3.98,兩者之差是所有元素中電負性差值最大的,因此氟化銫CsF是典型的離子型化合物。
但是,值得注意的是,即使是最典型的金屬離子與最典型的非金屬離子的結合也不完全是純靜電作用,仍有部分共價性質。如氟化銫CsF分子中,其離子性成分也只是92%,其餘8%為共價性成分。這說明即便是像銫和氟這樣典型的金屬和典型的非金屬形成化學鍵時,成鍵原子軌道之間依然有部分重疊。對於其他元素間形成的化學鍵,其共價成分顯然會更高。因此沒有百分之百的離子鍵,也有百分之百的共價鍵,離子鍵中有共價成分,共價鍵中也有離子性,只是主次不同而已。一般認為,當成鍵元素的原子電負性差值AX>1.7,鍵的離子性>50%,即是離子性為主,可認為是離子鍵。
離子鍵的特點
1、離子鍵沒有方向性
離子都是帶電體,它的電荷分布是球形對稱的。由於球形電場或點電荷是無方向性的,只要條件許可,離子在空間各方向上的電性作用相同,無論在哪個方向都能與電荷相反的離子相互吸引,因而離子鍵沒有方向性。
2、離子鍵沒有飽和性
由於離子鍵主要是正、負離子問的靜電引力,只要空間條件許可,每個離子總是儘可能多地與異性離子相吸引,因此離子鍵也沒有飽和性。
當然,離子晶體中離子吸引異號電荷離子的數目不是任意的,它受到離子空間效應的影響。只要在離子周圍還有空間接納異號電荷離子,並且不至於由於吸引的異號電荷離子之間因離子間的斥力而使其瓦解,離子將儘可能多地吸引異性離子。距離較遠的異號離子之間不過是引力較弱,而不是靜電引力已達到飽和。如NaCl晶體中,Na 離子與cl 離子個數比為1:1,每個Na 離子周圍有6個cl 離子,每個C1 離子周圍也有6個Na 離子。這並不意味著每個Na 離子周圍吸引了6個Cl 離子後它的靜電場就飽和了。事實上,在稍遠的距離處又有12個Cl 離子,再遠處又有18個Cl 離子等等,並且靜電吸引力隨距離的增大而減弱。
決定離子化合物性質的主要因素
由離子鍵理論可知,組成離子化合物的基本微粒是離子,影響離子化合物性質的因素是多方面的。如離子電荷、離子半徑和離子的電子構型等,但是離子化合物採用哪一種晶格,主要取決於陰、陽離子半徑比,也就決定著化合物的性質。
1、離子電荷
離子電荷是指原子在形成離子化合物過程中失去或獲得電子數。正離子通常只由金屬原子形成,其電荷等於中性原子失去電子的數目。此外,還有一些帶正電荷的原子團(如NH4 )等。負離子通常只由非金屬原子形成,其電荷等於中性原子獲得電子的數目;同樣也還有帶負電荷的原子團(如so ,co 等)。離子電荷高,與相反電荷的吸引力大,因而熔點、沸點就高。例如:CaO的熔點(2614℃)比NaCI(801℃)高。離子電荷不僅影響離子化合物的物理性質,也影響離子化合物的化學性質。又如鐵形成Fe 和Fe 兩種離子,它們相應的化學性質也就不同。
2、離子半徑
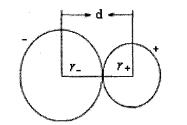 核間距
核間距離子半徑是指離子晶體中正、負離子接觸的半徑。在離子化合物中相鄰的正、負離子的靜電吸引作用和它的核外電子之間以及原子核之問的排斥作用達到平衡時,正、負離子問保持的最短距離稱為核間距,結晶學上用符號d表示,可用X射線衍射法測定。核間距可以看做是相鄰兩個離子半徑之和,即d=r+r。如右網所示:
核外電子沒有固定的運動軌道,實驗測得的數值如何分割給正、負離子呢?這令化學家大費腦筋,因為採用不同的分割方法會得出不同的結果。1926年,戈德施米特(Goldschmidt)以光學法測得的F 半徑和0 半徑依次為133 pm和132 pm為基礎,再計算其他離子半徑,如實驗測得NaF和NaCl的核間距分別為230pm和278pm,根據d=r+r即求得Na 和CI 的離子半徑。r=230-133=97(pm) ;r=278-97=181(pm)。
3、離子的電子構型
原子究竟能形成何種電子構型的離子,除取決於原 子本身的性質和電子層構型本身的穩定外,還與其相作用的其他電子有關。一般簡單的負離子,如F、cr、0等的最外層都為穩定的稀有氣體結構,即8電子構型。然而,對正離子來說,情況比較複雜,除了8電子結構外,還有其他多種構型。正離子的電子層構型大致有以下幾種:
(1)2電子構型::最外層為2個電子的離子。如LiBe等。
(2)8電子構型:最外層為8個電子的離子。如K等。
(3)18電子構型:最外層為18個電子的離子。如Zn、cd、Ag等。
(4)(18+2)電子構型:次外層為18個電子,最外層為2個電子的離子。如Pb、Sn等。
(5)不飽和電子構型:最外層為9~17個電子的離子,如Fe、Mn等。
離子的電子層構型對化合物的性質有一定的影響,例如鹼金屬和銅分族,它們最外層只有1個ns電子,都能形成+1價離子,如Na、.K、Cu、Ag,但由於它們的電子層構型不同。Na、K為8電子構型,Cu、Ag為18電子構型,因此它們的化合物(如氯化物)的性質就有明顯的差別。如:NaCl易溶於水,CuCl、AgCI難溶於水。