定義
離子的極化力是指某種離子使異號離子極化(即變形)的能力。
影響因素
離子極化力與離子的電荷、半徑以及離子的電子構型等因素有關。離子的電荷越多, 半徑越小,離子的極化力越強;當離子的電荷相同,半徑相近時,18 電子、(18 + 2 ) 電子以 及 2 電子構型的離子具有強的極化力;(9 ~ 17 ) 電子構型的離子次之;8電子構型的離子極化力最弱。
離子極化
離子極化定義
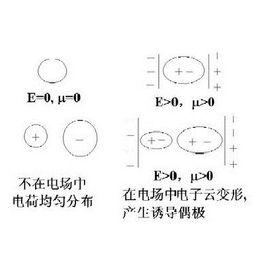
分子極化的概念也可以推廣到離子體系,因為離子之間也有極化作用。 對孤立的簡單離子來說,離子的電荷分布基本上是球形對稱的,離子本身正、負電荷中心是重合的,不存在偶極矩。但當離子置於外加電場中,離子的原子核就會受到正電場的排斥和負電場的吸引;而離子中的電子則會受到正電場的吸引和負電場的排斥,原子核與電子發生相對位移,導致離子變形而產生誘導偶極。這個過程稱為離子的極化。
離子極化過程
由於離子的外層電子不如內層電子與原子核的聯繫緊密,在外電場作用下容易與核發生相對位移,因此離子的變形可以近似理解為離子最外層電子云的變形。 在離子晶體中,每個離子都帶有電荷,本身就會在其周圍產生相應的電場。當陰、陽 離子充分接近時,陽離子使陰離子發生極化(即陽離子吸引陰離子的電子云而引起陰離子變形,同時陰離子使陽離子發生極化(即陰離子排斥陽離子的電子云而引起陽離子變 形 ),產生誘導偶極。顯然 ,離子極化的強弱取決於兩個因素:一是離子的極化力;二是離子的變形性。
離子極化的規律
一般來說,陽離子由於帶正電荷,半徑小外層電子數少,極化力較強,變形性不大;而陰離子半徑一般較大,外層電子數多,容易變形,極化力較弱。因此,當陽、陰離子相互作用時,主要考慮陽離子對陰離子的極化作用,而陰離子對陽離子的極化作用可以忽略。離 子極化的一般規律如下。
1、陰離子半徑相同時,陽離子的電荷越多,半徑越小,陰離子越容易被極化,產生的誘 導偶極越大。
2、陽離子的電荷相同、大小相近時,陰離子半徑越大,越容易被極化,產生的誘導偶極越大。
離子極化對化合物溶解度的影響
離子極化使離子鍵逐步過渡到共價鍵。根據相似相溶原理,離子極化的結果必然導致化合物在水中的溶解度降低。例如,在銀的鹵化物 中,由於離子極化作用依次增強,化學鍵中離子成分依次減小,共價成分依次增大,AgF、 AgCI、AgBr、Agl在水中的溶解度依次減小。 應該指出,影響化合物溶解度的因素是多方的,但離子極化往往起著重要的作用。
離子極化對化合物顏色的影響
物質呈現出不同的顏色,是對不同波長的可見光選擇性吸收的結果。物質對可見光的吸收與否,取決於組成物質的粒子的基態與激發態的能量差,只有當光子的能量與物質的粒子的基態與激發態能量之差相等時,可見光才能被吸收。典型的離子型化合物,其基態與激發態的能量差較大,激發時一般不吸收可見光,因此在白光照射下為無色物質。離子極化使晶體中的化學鍵由離子鍵向共價鍵過渡, 使基態與激發態之間的能量差減小,當白光照射在物質上,某些波長的可見光被吸收,因而呈現顏色。在可見光能量範圍內,離子極化作用越強,基態與激發態的能量差越小,吸收可見光的波長越長,物質呈現的顏色越深。例如,在鹵化銀中,隨著鹵離子的半徑增大,鹵離子與銀離子間的相互極化作用增強,基態與激發態的能量差依次減小,鹵化銀的顏色依次加深。
離子極化對化合物的熔點和沸點的影響
離子極化作用的結果,使離子鍵向共價鍵過渡,導致化合物的熔點和沸點降低。如 AgCl和 NaCl,由於銀離子的極化能力大於鈉離子,導致鍵型不同,所以氯化銀的熔點是728 K ,而 NaCl的熔點是1074 K。又如氯化汞,汞離子是18電子構型,極化能力強,又有較大的變形性,氯離子也具有一定的變形性,離子的相互極化作用使氯化汞的化學鍵有顯著的共價性,因此氯化汞的熔點為550K ,沸點為 577K,都較低。