性質
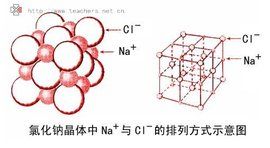
離子晶體中正、負離子或離子集團在空間排列上具有交替相間的結構特徵,因此具有一定的幾何外形,例如NaCl是正立方體晶體,Na離子與Cl離子相間排列,每個Na離子同時吸引6個Cl離子,每個Cl離子同時吸引6個Na。不同的離子晶體,離子的排列方式可能不同,形成的晶體類型也不一定相同。離子晶體不存在分子,所以沒有分子式。離子晶體通常根據陰、陽離子的數目比,用化學式表示該物質的組成,如NaCl表示氯化鈉晶體中Na離子與Cl離子個數比為1:1, CaCl2表示氯化鈣晶體中Ca離子與Cl離子個數比為1:2。
離子晶體整體上具有電中性,這決定了晶體中各類正離子帶電量總和與負離子帶電量總和的絕對值相當,並導致晶體中正、負離子的組成比和電價比等結構因素間有重要的制約關係。
如果離子晶體中發生位錯即發生錯位,正正離子相切,負負離子相切,彼此排斥,離子鍵失去作用,故無延展性。如CaCO3可用於雕刻,而不可用於鍛造。因為離子鍵的強度大,所以離子晶體的硬度高。又因為要使晶體熔化就要破壞離子鍵,所以要加熱到較高溫度,故離子晶體具有較高的熔沸點。離子晶體在固態時有離子,但不能自由移動,不能導電,溶於水或熔化時離子能自由移動而能導電。因此水溶液或熔融態導電,是通過離子的定向遷移導電,而不是通過電子流動而導電
岩漿晶出規則
晶格能越大的晶體,熔點越高,越早達到飽和,更容易在岩漿冷卻過程中先析出晶體。
 離子晶體
離子晶體