分子式
 銨鹽
銨鹽銨鹽NHCl = Ammonium chloride(氯化銨,無色立方晶體或白色結晶)。
(NH)SO = Ammonium Sulphate(硫酸銨,白色結晶,是硫酸根與銨根離子化和生成的化合物)。
NHNO = Ammonium nitrate(硝酸銨,無色斜方或單斜晶體)。
(NH)CO=AmmoniumCarbonate Crystalammonia (碳酸銨,無色半透明堅硬結晶塊或粉末)。
 銨鹽
銨鹽種類
 氯化銨
氯化銨NH4Cl 氯化銨,(NH4)2SO4 硫酸銨,NH4HSO4 硫酸氫銨,NH4NO3 硝酸銨,(NH4)2CO3 碳酸銨,NH4HCO3 碳酸氫銨,NH4F 氟化銨,NH4I 碘化銨,NH4Br 溴化銨等。
銨鹽的定義
氨與酸反應
 銨鹽
銨鹽的生成物都是由銨離子和酸根離子構成的離子化合物,這類化合物稱為銨鹽。
銨鹽共性
1.銨鹽是離子型化合物,都是白色晶體(NH4MnO4是紫黑色),易溶於水,溶水時吸熱。
2.受熱分解(不穩定性)
NH4Cl == NH3↑ + HCl↑
NH4HCO3 == NH3↑ + CO2↑ + H2O(條件均為加熱)
氯化銨受熱分解為氯化氫和氨氣,遇冷時二者又重新結合為氯化銨,類似於“升華”現象,但不同於I2的升華。NH4HCO3加熱則完全氣化,也出現類似“升華”的現象。
銨鹽受熱分解的產物要根據具體情況分析,一般與溫度和銨鹽里的酸根的氧化性等諸多因素有關。
如:NH4NO3===440K===N2O↑+2H2O
3.與鹼反應
NH4+ + OH- == NH3↑ + H2O(加熱)
可以用來檢驗NH4+ 也可用來製作氨氣。
用濕潤紅色石蕊試紙在瓶口驗滿。
4.特徵反應
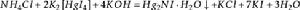 銨鹽
銨鹽生成的
為紅棕色沉澱,可以檢驗甚至微量的
離子。
和
的混合溶液又叫做奈斯勒試劑。
銨鹽的用途
具有強烈的殺菌和抑霉防蛀性能。氯化十二烷基二甲基苄基銨可用作腈綸的勻染劑。季銨鹽分子中的兩個烷基是長鏈烷基的產品,對各種纖維具有良好的柔軟作用,能使纖維膨脹柔軟,外觀美觀而平滑,富有良好手感,是一種常用的纖維柔軟劑。溴化雙十八烷基二甲基銨,不僅是殺菌劑,而且對棉、毛、合成纖維織物都具有顯著的柔軟作用。十八烷基二甲基羥乙基銨硝酸鹽是一種極好的抗靜電劑。季銨鹽還可作防水劑、緩染劑、石油破乳劑等。用脂肪酸為原料,經氨化製得脂肪腈,再經氫化為脂肪胺,然後將伯胺與溴代烷反應,即得季銨鹽。亦可用叔胺為原料,在常壓下與溴代烷加熱直接縮合為季銨鹽。
銨鹽的特性
1.銨
[mod_image_5312661]
鹽是離子化合物
2.易溶於水
氯化銨受熱分解。
在收集氣體的試管口要堵棉花,便於集滿。
在驗滿時,用濕潤的紅色石蕊試紙放在試管口,若變藍色則已滿;也可用玻璃棒蘸取濃鹽酸放在試管口,若產生大量白煙則滿。
在驗滿後,應立即停止加熱,在試管口放一團用水或鹽酸浸濕的棉花球以吸收多餘的氨,防止污染空氣。
請兩位學生上講台來制氨氣,其餘同學評議。
可用鹼石灰,不能用濃硫酸,因為硫酸可與氨氣反應。
現象:試管內壁附有白色固體
3.受熱分解
氯化銨受熱分解為氯化氫和氨氣,遇冷時二者又重新結合為氯化銨,類似於“升華”現象,但不同於I2的升華。NH4HCO3加熱則完全氣化,也出現類似“升華”的現象,請用化學方程式表示。
銨鹽受熱分解的產物要根據具體情況分析,一般與溫度和銨鹽里的酸根的氧化性等諸多因素有關。
銨鹽這類氮肥都是銨態氮肥,在貯存和施用時應注意的事項是什麼?
銨鹽的不穩定性。

