主要特性
普遍性
 酶促反應
酶促反應2、可以加快化學反應的速度,而不改變反應的平衡點,即不改變反應的平衡常數;
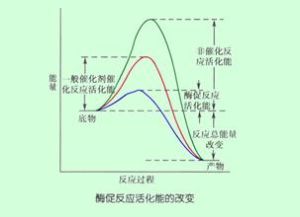
3、作用機理都是降低反應的活化能;
4、在反應前後,酶沒有質和量的改變,且微量的酶便可發揮巨大的催化作用。
特殊性
但是酶也具有不同於其他催化劑的特殊性。在酶促反應中,酶作為高效催化劑,使得反應以極快的速度或在一般情況無法反應的條件下進行。
酶是生物體內進行各種化學反應最重要的物質。
特點
一、酶促反應具有極高的效率二、酶促反應具有高度的特異性
酶的特異性是指酶對底物的選擇性,有以下三種類型:
1.絕對特異性酶只作用於特定結構的底物,生成一種特定結構的產物。如澱粉酶只作用澱粉。
2.相對特異性酶可作用於一類化合物或一種化學鍵。例如磷酸酶可作用於所有含磷酸酯鍵的化合物。
3.立體異構特異性一種產僅作用於立體異構體中的一種。例如L-乳酸脫氫酶只作用於L-乳酸,而對D-乳酸不起催物作用。
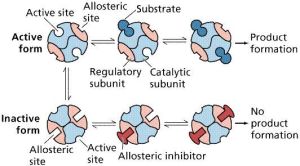
三、酶活性的可調節性
四、酶活性的不穩定性
因素
溫度、酸鹼度、酶的濃度、被催化物質的濃度、抑制劑、激活劑、反應產物底物濃度對酶反應速度的影響底物濃度的改變,對酶反應速度的影響比較複雜。在一定的酶濃度下當底物濃度較低時(底物濃度從0逐漸增高),反應速度與底物濃度的關係呈正比關係(如右圖);隨著底物濃度的增加,反應速度不再按正比升高;如果再繼續加大底物濃度,反應速度卻不再上升,趨向一個極限。
影響
在一定的溫度和pH條件下,當底物濃度足以使酶飽和的情況下,酶的濃度與酶促反應速度呈正比關係。pH對酶反應速度的影響
pH對酶促反應速度的影響酶反應介質的pH可影響酶分子,特別是活性中心上必需基團的解離程度和催化基團中質子供體或質子受體所需的離子化狀態,也可影響底物和輔酶的解離程度,從而影響酶與底物的結合。只有在特定的pH條件下,酶、底物和輔酶的解離情況,最適宜於它們互相結合,並發生催化作用,使酶促反應速度達最大值,這種pH值稱為酶的最適pH。
胰蛋白酶大部分酶的活力受其環境pH的影響,在一定pH下,酶促反應具有最大速度,高於或低於此值,反應就會下降,通常稱此pH為酶的最適pH。不同酶的最適pH不同。
右圖:例如:胃蛋白酶的最適pH為1.5~2.2,胰蛋白酶的最適pH為8.0~9.0,唾液澱粉酶的最適pH為6.8等。動物酶多在pH6.5~8.0之間,植物及微生物多在pH4.5~6.5之間,但也有例外。如:真菌的最適pH為5.0~6.0,多數細菌的最適為6.5~7.5,放線菌的最適在7.5~8.5。
體內多數酶的最適pH值接近中性,但也有例外,如胃蛋白酶的最適pH約1.8,肝精氨酸酶最適pH約為9.8。溶液的pH值高於和低於最適pH時都會使酶的活性降低,遠離最適pH值時甚至導致酶的變性失活(圖)。所以測定酶的活性時,應選用適宜的緩衝液,以保持酶活性的相對恆定。臨床上根據胃蛋白酶的最適PH偏酸這一特點,配製助消化的胃蛋白酶合劑時加入一定量的稀鹽酸,使其發揮更好的療效。
pH影響酶活性的主要原因
過酸、過鹼影響了酶分子的結構,甚至使酶變性失活。
應該注意的是,酶在試管中的最適pH與它在正常細胞中的生理pH值並不一定完全相同。這是因為一個細胞內可能會有幾百種酶,不同的酶對此細胞內的生理pH的敏感性不同;也就是說此pH對一些酶是最適pH,而對另一些酶則不是,不同的酶表現出不同的活性。這種不同對於控制細胞內複雜的代謝途徑可能具有很重要的意義。
溫度對酶促反應速度的影響
化學反應的速度隨溫度增高而加快,但酶是蛋白質,可隨溫度的升高而變性。在溫度較低時,前一影響較大,反應速度隨溫度升高而加快。但溫度超過一定範圍後,酶受熱變性的因素占優勢,反應速度反而隨溫度上升而減慢。常將酶促反應速度最大的某一溫度範圍,稱為酶的最適溫度。
人體內酶的最適溫度接近體溫,一般為37℃~40℃之間,若將酶加熱到60℃即開始變性,超過80℃,酶的變性不可逆。
溫度對酶促反應速度的影響在臨床實踐中具有指導意義。低溫條件下,酶的活性下降,但低溫一般不破壞酶,溫度回升後,酶又恢復活性。所以在管理技術操作中對酶製劑和酶檢測標本(如血清等)應放在冰櫃中低溫保存,需要時從冰櫃取出,在室溫條件下等溫度回升後再使用或檢測。溫度超過80℃後,多數酶變性失活,臨床套用這一原理進行高溫滅菌。
酶的最適溫度與反應所需時間有關,酶可以在短時間內耐受較高的溫度,相反,延長反應時間,最適溫度便降低。據此,在生化檢驗中,可以採取適當提高溫度,縮短時間的方法,進行酶的快速檢測。
不同的溫度對活性的影響不同,但都有一個最適溫度。在最適溫度的兩側,反應速度都比較低。
溫度對酶促反應的影響包括兩方面:一方面是當溫度升高時,反應速度也加快,這與一般化學反應相同。另一方面,隨溫度升高而使酶逐步變性,即通過減少有活性的酶而降低酶的反應速度。在低於最適溫度時,前一種效應為主,在高於最適溫度時,則後一種效應為主,因而酶活性喪失,反應速度下降。
在製備培養基的過程中,可採用高溫對培養基進行滅菌,主要是破壞了微生物體內的酶的活性。採用高溫滅菌在醫學和生活實踐中都有較廣泛的套用。
在低溫的條件下,酶的活性降低,但酶分子的結構一般還會發生改變。所以,人們可以選擇在低溫下保存酶。在生活實踐中人們也經常選擇在低溫下較長時間保存食品。
抑制劑的作用
通過改變酶必需基團的化學性質從而引起酶活力降低或喪失的作用稱為抑制作用,具有抑制作用的物質稱為抑制劑,抑制劑通常是小分子化合物,但在生物體內也存在生物大分子類型的抑制劑。
酶的抑制劑分類
酶的抑制劑分為不可逆抑制劑和可逆抑制劑兩大類。不可逆抑制劑與酶的必需基團以共價鍵結合,引起酶的永久性失活,其抑制作用不能夠用透析,超濾等溫和物理手段解除。可逆抑制劑與酶蛋白以非共價鍵結合,引起酶活性暫時性喪失,其抑制作用可以通過透析、超濾等手段解除。可逆抑制劑又分為競爭性抑制劑、非競爭性抑制劑和反競爭性抑制劑等。
激活劑的作用
酶的活力可以被某些物質提高,這些物質稱為激活劑,在酶促反應體現中加入激活劑可導致反應速率增加。通常酶對激活劑有一定選擇性,且有一定濃度要求,一種酶的激活劑對另一種酶可能是抑制劑,當激活劑的濃度超過一定的範圍時,它就成為抑制劑。