成份
 達力士
達力士本品主要成份為卡泊三醇。
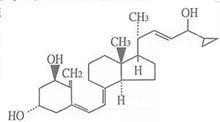
化學名稱:9,10-開環膽甾-24-環丙基-5,7,10(19),22-四烯-1,3,24三醇。
化學結構式:
分子式:CHO
分子量:412.61
性狀
本品為白色軟膏,不含防腐劑。
適應症
用於尋常型銀屑病的局部治療。
規格
0.005%(15g:0.75mg,30g:1.50mg)
用法用量
將本品少量塗於患處皮膚,每日1~2次。推薦在治療初期每日給藥2次,適當時可減為每日1次給藥。每周最大用量不應超過100g。
不良反應
非常常見 ]1/10
常見 ]1/100並且[1/10
少見 ]1/1000並且[1/100
罕見 ]1/10000並且[1/1000
非常罕見 [1/10000
最常報導的不良反應多為皮膚反應。特別是用藥部位的反應。高鈣血症和過敏反應的報導非常罕見。
根據臨床數據,達力士®軟膏的不良反應發生率約為15%左右。
瘙癢症,皮膚刺激,灼燒感,刺痛感,皮膚乾燥,紅斑和皮疹較常見。接觸性皮炎,濕疹,銀屑病惡化少見。
局部使用後導致出現全身反應的高鈣血症和高鈣尿症非常罕見。
達力士®乳膏、軟膏和頭皮搽劑上市後數據
非常罕見有報導暫時性皮膚色素沉著、暫時性光敏反應,過敏反應包括蕁麻疹、血管性水腫、眼周水腫或面部水腫。罕有出現口周皮炎。
根據上市後數據,不良反應的總報導率非常低。大約為1:10000例患者。
McdDRA SOC列出了不良反應,單個不良反應根據報導的出現頻率順序列出。
皮膚和皮下組織不適
瘙癢、燒灼感、皮膚刺痛感、皮膚刺激、皮膚乾燥、紅斑、皮疹*、濕疹、接觸性皮炎、銀屑病惡化、皮膚色素沉著、皮膚色素減退、光敏反應、蕁麻疹、面部水腫、眼周水腫、血管性水腫。
*不同類型皮疹已有報導,如:鱗狀的、紅斑的、斑丘疹的、膿皰的。
代謝和營養紊亂:
高鈣血症、高鈣尿症。
禁忌
1.對本品任何成份過敏者禁用;
2.鈣代謝失調者禁用。
注意事項
達力士[sup]®[/sup]軟膏不套用於面部。患者必須按說明書正確使用本品,以避免直接用於面部成偶然塗於面部。每次用藥後必須小心洗去手上殘留的藥物。
有嚴重腎衰竭或嚴重肝臟功能不全的患者應避免使用達力士[sup]®[/sup]。
按照推薦給藥劑量使用本品出現高鈣血症的風險非常小。如果每周使用量超過最大使用劑量(100g),則有可能會導致高鈣血症,停藥後血清鈣水平可很快恢復正常。
在使用達力士[sup]®[/sup]治療期間,推薦醫生建議患者限制或避免過度暴露在自然光或人工光下。只有在醫生和患者均認為潛在的利益大於潛在的風險時,局部卡泊三醇用藥後可與紫外照射聯用。
本品輔料中含有丙二醇,其可能會引起皮膚刺激。
孕婦及哺乳期婦女用藥
動物實驗未發現本品有致畸作用,但本品用於孕婦的安全性尚未確定。不確定卡泊三醇是否通過乳汁排泄,因此本品不應在妊娠和哺乳期使用。
兒童用藥
本品兒童用藥的安全性尚未確定。
老年用藥
未進行該項試驗且無可靠參考文獻。
藥物相互作用
未進行該項試驗且無可靠參考文獻。
藥物過量
過量使用本品(每周超過100g)可能導致高鈣血症,停藥後血清鈣水平可很快恢復正常。有報導顯示,較低劑量用於泛發性膿皰型銀屑病或紅皮病型銀屑病患者時出現高鈣血症。
藥理毒理
藥理作用:
本品為維生素D衍生物卡泊三醇的外用製劑,能抑制皮膚細胞(角脘細胞)增生和誘導其分化,從而使銀屑病皮損的增生和分化異常得以糾正。
毒理研究:
本品對鈣代謝的影響大約為激素活化型維生素D3的1/100。
在小鼠進行的致皮膚癌研究表明沒有任何特殊的致皮膚癌的風險。卡泊三醇溶液按3個劑量組3、10和30mg/kg/天(按體表面積計,分別為9、30和90mg/m2/天。相當於對60kg的成人最大推薦日劑量達的0.25、0.84和2.5倍)局部使用24個月。高劑量是卡泊三醇的皮膚最大耐受劑量。在10和30mg/kg/天組的生存率降低,尤其是對雄性鼠。生存率的降低與梗阻性尿路病發生的升高有關。與治療有關的最大變化可能是尿成分的變化。這與高劑量卡泊三醇和維生素D類似物使用的預期一致。未見對皮膚的影響,未見經皮或全身致癌作用。
在一項白化裸鼠的研究中,重複暴露在UV照射和局部使用卡泊三醇40周,藥物劑量水平與前述經皮致癌試驗相同,觀察到減少UV照射皮膚出現皮膚癌降低的現象(僅在雄性鼠中有統計學意義),提示卡泊三醇可能會升高UV照射誘導皮膚癌的作用。這些發現的臨床相關性尚不明確。
藥代動力學
動力學研究表明口服給藥經肝臟代謝,半衰期很短,人肝臟勻漿外實驗顯示人的代謝途徑與鼠,豚鼠,兔相似,主要代謝物無藥理活性。
卡泊三醇經皮膚吸收為給藥劑量的1%-5%。
貯藏
儲存於室溫下(15℃-25℃)。應置於兒童無法取到的地方。
包裝
帶乙烯旋蓋的鋁管包裝,15克/支,30克/支。
有效期
24個月
執行標準
進口藥品註冊標準:JX20020150
生產企業
愛爾蘭利奧製藥有限公司
核准日期
2007-03-28
修訂日期
2010年12月10日

