成份
 艾達生
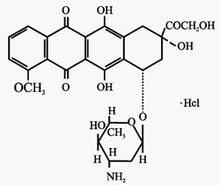
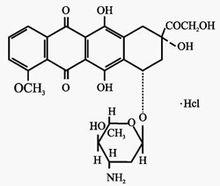
艾達生化學名稱:本品的主要成分為鹽酸表柔比星,化學名為(7S:9S)-9-羥乙醯基-4-甲氧基-7,8,9,10-四氫-6,7,9,11-四羥基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮鹽酸鹽。
化學結構式:
分子式:CHNO·HCL
分子量:579.98
輔料:乳糖
性狀
本品為鮮紅色或橙紅色凍乾塊狀物;有引濕性。
適應症
用於治療白血病,惡性淋巴瘤,多發性骨髓瘤,乳腺癌 、肺癌 、軟組織肉瘤、胃癌 、肝癌、結腸直腸癌、卵巢癌等。
規格
10mg
用法用量
表柔比星單獨用藥時,成人劑量為按體表面積一次60~90mg/m[sup]2[/sup],聯合化療時,每次50~60mg/m[sup]2[/sup]靜脈注射。根據病人血象可間隔21天重複使用。
不良反應
1.與阿黴素相似,但程度較低,尤其是心臟毒性和骨髓抑制毒性;
2.其它不良反應有:脫髮,60~90%的病例可發生,一般可逆,男性有鬍鬚生長受抑;黏膜炎,用藥的第5~10天出現,通常發生在舌側及舌下黏膜;胃腸功能紊亂,如噁心、嘔吐、腹瀉;曾有報導偶有發熱、寒顫、蕁麻疹、色素沉著、關節疼痛。
禁忌
1.禁用於因用化療或放療而造成明顯骨髓抑制的病人;
2.已用過大劑量蒽環類藥物(如阿黴素或柔紅黴素)的病人;
3.近期或既往有心臟受損病史的病人。
注意事項
1.關於心臟毒性
(1)可導致心肌損傷,心力衰竭。動物實驗和短期人體實驗表明,表柔比星的心臟毒性比它的同分異構體阿黴素小。比較性研究表明,表柔比星和阿黴素引起相同程度心功能減退的蓄積劑量之比為2:1。在表柔比星治療期間仍應嚴密監測心功能,以減少發生心力衰竭的危險(這種心力衰竭甚至可以在終止治療幾周后發生,並可能對相應的藥物治療無效);
(2)對目前或既往接受縱隔、心包區合併放療的病人,表柔比星心臟毒性的潛在危險可能增加;
(3)在確定表柔比星最大蓄積劑量時,與任何具有潛在心臟毒性藥物聯合用藥時應慎重;
(4)在每個療程前後都應進行心電圖檢查。蒽環類,尤其是阿黴素所引起的心肌病,在心電圖上表現為QRS波群持續性低電壓、收縮間期的延長超過正常範圍(PEP/LVET),以及射血分數減低。對接受表柔比星治療的病人,心電監護是非常重要的,可以通過無創傷性的技術如心電圖、超聲心動圖來評估心臟功能。如有必要,可通過放射性核素血管造影術測量射血分數。
2.關於肝腎功能影響
(1)由於表柔比星經肝臟系統排泄,故肝功能不全者應減量,以免蓄積中毒。中度肝功能受損者(膽紅素1.4~3mg/100ml或BSP滯留量9~15%),藥量應減少50%。重度肝功能受損者(膽紅素大於3mg/100ml或BSP滯留量大於15%)藥量應減少75%;
(2)中度腎功能受損患者無需減少劑量,因為僅少量的藥物經腎臟排出。表柔比星和其它細胞毒藥物一樣,因腫瘤細胞的迅速崩解而引起高尿酸血症。應檢查血尿酸水平,通過藥物控制此現象的發生;另外,在用藥1~2天內可出現尿液紅染;
3.關於骨髓抑制
可引起白細胞及血小板減少,應定期進行血液學監測。
4.關於給藥說明
(1)靜脈給藥,用滅菌注射用水稀釋,使其終濃度不超過2mg/ml。
(2)建議先注入生理鹽水檢查輸液管通暢性及注射針頭確實在靜脈之後,再經此通暢的輸液管給藥。以此減少藥物外溢的危險,並確保給藥後靜脈用鹽水沖洗。
(3)表阿黴素注射時溢出靜脈會造成組織的嚴重損傷甚至壞死。小靜脈注射或反覆注射同一血管會造成靜脈硬化。建議以中心靜脈輸注較好。
(4)不可肌肉注射和鞘內注射。
孕婦及哺乳期婦女用藥
尚無定論性資料說明表柔比星對人的生育力是否有不利影響,以及對胎兒是否有致畸作用或其它有害影響。但有實驗資料提示表柔比星與大多數抗腫瘤藥物和免疫抑制劑類似,在特定試驗條件下,在動物身上表現出致突變性和致癌性,可以降低胎兒的成活率。因此在妊娠期間不主張使用本品,哺乳期婦女禁用。
兒童用藥
兒童用藥無特殊要求。
老年用藥
老年患者伴心功能減退者宜慎用或減量。
藥物相互作用
1.表柔比星可與其他抗腫瘤藥物合用,但表柔比星用量應減低。聯合用藥時,不得在同一注射器內使用。
2.表柔比星不可與肝素混合注射,因為二者化學性質不配伍,在一定濃度時會發生沉澱反應。
藥物過量
本品總限量為按體表面積550~800mg/m[sup]2[/sup]
臨床試驗
 艾達生
艾達生 艾達生
艾達生 艾達生
艾達生 艾達生
艾達生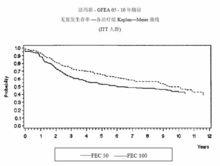 艾達生
艾達生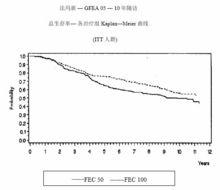 艾達生
艾達生以上主要來自國外臨床研究資料
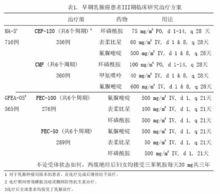
兩項隨機、開放、多中心臨床研究評估了表柔比星100~120mg/m[sup]2[/sup] 聯合環磷醯胺與氟脲嘧啶,輔助治療腋下淋巴陽性不伴遠處轉移的乳腺癌患者(II或III期)。MA-5研究對表柔比星每個療程120mg/m[sup]2[/sup]聯合環磷醯胺與氟脲嘧啶(CEF-120)方案進行了評估,該研究將伴有1個或以上淋巴結轉移的絕經前和圍絕經期女性患者隨機分為含有表柔比星的CEF-120組或CMF組。GFEA-05研究則評估了表柔比星每個療程100mg/m[sup]2[/sup]聯合氟脲嘧啶與環磷醯胺(FEC-100方案),將絕經前和絕經後女性患者隨機分為FEC-100組或較低劑量的FEC-50組。GFEA-05研究入組患者要求伴有4個或以上淋巴結陽性,或,如果陽性淋巴結為1-3個,則要求患者雌激素和孕酮受體為陰性,而且腫瘤組織學為3級或2級。這兩項研究共入選1281名婦女,腫瘤組織學4級的患者均未入選。
表1列出各治療方案,試驗的主要終點指標為無復發生存時間(包括發生局部或區域復發、遠處轉移或疾病相關性死亡的時間)。最後一次隨訪時記錄是否發生對側乳腺癌、患第二種原發性腫瘤或非乳腺癌導致的死亡。
MA-5研究中,患者中位年齡45歲,腫瘤淋巴結轉移1-3個占60%,4個或以上占40%。GFEA-05研究中,中位年齡51歲,近半數為絕經後患者,腫瘤淋巴結轉移1-3個占17%,4個或以上占80%。每項研究兩組的人口統計學及腫瘤特徵均相近。
兩項研究的療效學指標為意向性治療(ITT)患者的無復發生存(RFS)及總體生存(OS),採用Kaplan-Meier方法分析。隨訪5年時進行了首次分析,結果見表2及下文,隨訪10年的分析結果列於表2。MA-5研究中,含有表柔比星的聯合治療方案(CEF-120)無復發生存率顯著高於CMF方案(5年無復發生存率分別為62%和53%,logrank分層分析 p=0.013),5年復發風險降低24%。表柔比星為主聯合治療方案(CEF-120)的總體生存率也高於CMF(5年總生存率分別為77%和70%,logrank 分層分析 p=0.043;logrank未分層分析p=0.13)。5年的死亡風險降低29%。在GFEA-05研究,高劑量表柔比星治療(FEC-100)患者5年無復發生存率和總體生存率均顯著高於低劑量組(FEC-50),兩組5年無復發生存率分別為65%和52%(logrank檢驗p=0.007),總體生存率分別為76%和65%(logrank 檢驗 p=0.007),5年的復發風險降低32%,死亡風險降低31%。MA-5和GFEA-0510年隨訪(中位隨訪時間分別為8.8年和8.3年)的結果見表2。雖然沒有設定亞組分析,但是在MA-5研究中,伴有1-3個淋巴結轉移和4個及以上淋巴結轉移的患者中,CEF-120方案治療的無復發生存率和總體生存率均優於CMF。在GFEA-05研究中,絕經前和絕經後患者接受FEC-100方案治療的無復發生存率和總體生存率也均優於接受FEC-50方案治療者。
MA-5研究無復發生存率和總體生存率的Kaplan-Meier曲線見圖1和圖2,GFEA-05研究無復發生存率和總體生存率的Kaplan-Meier曲線見圖3和圖4
圖 1.MA-5研究無復發生存率曲線
圖 2.MA-5研究總體生存率曲線
圖 3.GFEA-05研究無復發生存率曲線
圖 4.GFEA-05研究總體生存率曲線
5年和10年數據的統計分析見表2
藥理毒理
4'位置上的羥基由順位變為反位。為一細胞周期非特異性藥物,其主要作用部位是細胞核。本品的作用機制與其能與DNA結合有關。體外培養的細胞加入本品可迅速透入胞內,進入細胞核與DNA結合,從而抑制核酸的合成和有絲分裂。已證實表阿黴素具有廣譜的抗實驗性腫瘤的作用,對拓撲異構酶也有抑制作用。療效與阿黴素相等或略高,而毒性尤其是心臟毒性低於阿黴素。
藥代動力學
體內代謝和排泄較阿黴素快,平均血漿半衰期約40小時,主要在肝臟代謝,經膽汁排泄。48小時內,9~10%的給藥量由尿排出,4天內,40%的給藥量由膽汁排出,該藥不通過血腦屏障。對有肝轉移和肝功能受損的病人,該藥在血漿中的濃度維持時間較長,故應適當減小劑量。腎功能正常與否對本品的藥代動力學特性影響不大。
貯藏
密閉,在涼暗乾燥處(避光不超過20℃)保存。
包裝
抗生素玻璃瓶、紙盒,1瓶/盒。
有效期
24個月。
執行標準
YBH03762011
批准文號
國藥準字H19990280
生產企業
浙江海正藥業股份有限公司
核准日期
2007年04月03日
修訂日期
2009年12月21日 2011年11月04日