簡介
大豆中含有一種毒性物質,叫做胰蛋白酶阻礙因子(TI)。是在1944年發現的,一年後康尼茲( Kuntiz)成功地製成結晶。其性質概括如下:等電點為4.5,與球蛋白相似,相對分子質量21500,胺基酸殘基數為194,N末端是天冬氨酸,C末端是亮氨酸,含有兩個胱氨酸基而不含半胱氨酸基的鏈狀蛋白質。但根據最近的研究證明,胰蛋白酶阻礙因子並非單一的蛋白質,而是各種蛋白質的混合物,其數目為4-7個,其中之一顯示出和康尼茲所製取的,TI有同樣的性質。
阻礙機製作用
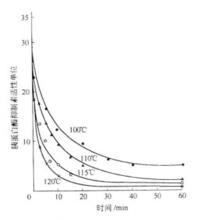 圖1 加熱對胰蛋白酶抑制素的影響
圖1 加熱對胰蛋白酶抑制素的影響由於康尼茲(Kunitz)提取了胰蛋白酶和TI混合物的結晶體,從而明確了它的阻礙作用的機制,它具有抑制小腸中胰蛋白酶活力的作用,因而食用後會妨礙食物中蛋白質的消化、吸收和利用,其毒性是可引起胰腸肥大。在濕熱條件下加熱時,胰蛋白酶阻礙因子容易被破壞。所以在食品加工的實際問題上,它的毒性並不重要。但另一種觀點認為大豆胰蛋白酶抑制素的熱穩定性是大豆加工中最為關注的問題之一。胰蛋白酶抑制素的熱穩定性比較高。在80℃時,其殘存活性仍在80%以上,而且增加熱處理時間並不能顯著降低其活性。因此要降低胰蛋白酶抑制素的活性需要繼續升高溫度,胰蛋白酶抑制素活性與加熱溫度、加熱時間的關係見圖1。從圖中可見,當加熱溫度為100℃,加熱時間為10min時,胰蛋白酶抑制素的活性單位為13,當加熱溫度為120℃,加熱時間為10min時,胰蛋白酶抑制素的活力單位只有3;從圖中還可以看出隨著加熱溫度的升高,加熱時間的延長,胰蛋白酶抑制素的活性單位逐漸變小,因此工業生產中可以根據不同需求而確定適宜的加熱溫度和加熱時間,使胰蛋白酶抑制素的活性降至生產所需達到的水平 。
TI在動物體內的作用
動物體內的胰蛋白酶和胰凝乳蛋白酶是分解食物蛋白質的專一蛋白酶。由於TI能分別與上述兩種蛋白酶活性中心專一性結合,使它們失去了分解蛋白質的能力,由此引起蛋白質消化率下降、營養效價降低。並導致消化不良、食慾下降、乃至生長停滯等不良反應。但另有研究報導,在動物飼料中加入預先消化過的蛋白質或混合胺基酸製品後,TI仍能抑制動物的生長。因此認為,TI抑制胰腺中蛋白酶的活性不是導致動物生長停滯的惟一原因。進一步研究發現,TI本身就能引起動物胰腺增大,從而加速刺激了胰腺分泌活性增加,促使胰腺機能產生亢進,導致胰臟過度分泌蛋白水解酶,結果造成了動物機體內必需胺基酸的內源性損失,進而也就降低了蛋白質本來的營養效價。另外,由於胰蛋白酶和胰凝乳蛋白酶均富含硫胺基酸,而當胰腺腫大時,勢必要消耗更多的含硫胺基酸來合成補充胰臟中損失的蛋白酶,從而造成機體組織內嚴重缺乏含硫胺基酸。又因大豆蛋白質本來就缺少含硫胺基酸,如此,則使必需胺基酸的自行損耗較多,且又不能及時得到補給,結果使胺基酸的比例失調,很難維持動物體內的營養需求,必然也就會導致動物的生長停滯。
胰腺的分泌是由其反饋抑制所調解控制的,而且此種抑制主要取決於小腸內胰蛋白酶和胰凝乳蛋白酶的含量。當這兩種酶的量達到正常水平時,就會反饋抑制胰腺中蛋白酶的合成。反之,當這兩種酶的含量下降到臨界值以下時,就會反射刺激胰腺來合成更多的酶。同時還認為,胰腺內蛋白酶的合成也可能是由激素性質的腸促胰酶肽所調控。由此可以推論,TI引起甲狀腺腫大的機制可能在於TI與胰蛋白酶結合形成複合物後,蛋白酶的含量明顯降低,此時負反饋抑制失去作用,而腸促胰酶肽的活性增強,促使胰腺合成蛋白酶,此過程稱之為負反饋抑制作用的抑制,結果使胰腺機能亢進而產生腫大。
一般認為大豆中至少存在5種胰蛋白酶抑制劑,但至今只有兩種被分離純化出來,並得到較詳細的研究。1947年和1961年,Kunitz與Bowman - Birk分別提純了兩種胰蛋白酶抑制劑,它們在豆中的含量分別為1.4%和0.6%。後來人們用他們的姓氏分別命名了這兩種胰蛋白酶抑制劑,其性能見圖2。
上述兩種抑制劑的等電點都處在偏酸性範圍,Bowlnan - Birk抑制劑對熱、酸、胃蛋白酶的穩定性及對胰凝乳蛋白酶的抑制作用均高於Kunitz抑制劑,這是因為前者每摩爾具有7個脫氨酸殘基,而後者只有2個。胱氨酸殘基的二硫化物能有效地穩定大分子結構。胰蛋白酶抑制劑的毒性是可引起胰臟肥大 。
 圖2 Kunitz胰蛋白酶與Bowman - Birk胰蛋白酶的特性
圖2 Kunitz胰蛋白酶與Bowman - Birk胰蛋白酶的特性