動物營養學
簡介
飼料的總能取決於其碳水化合物、脂肪和蛋白質含量。三大養分能量的平均含量為:碳水化合物 17.5 kJ/g ;蛋白質 23.64 kJ/g;脂肪39.54 kJ/g,其能量含量不同與其分子中C/H比和O、N含量不同有關,因為有機物質氧化釋放能量主要取決於C和H同外來O的結合,分子中C、H含量愈高,O含量愈低,則能量愈高,C/H比愈小,氧化釋放的能量愈多,因每克C氧化成CO2釋放的能量(33.81 kJ )比每克H氧化成H2O釋放的熱量(144.3 kJ )低。脂肪平均含77% C、12% H、11% O ;蛋白質平均含52% C、7% H、22% O;碳水化合物含44% C、6% H、50% O。脂肪含O最低,蛋白質其次,碳水化合物最高,因此,能值以碳水化合物最低,脂肪最高,約為碳水化合物2.25倍,蛋白質居中。同類化合物中不同養分產熱量差異的原因同樣可用元素組成解釋。如,澱粉產熱量高於葡萄糖,主要是每克澱粉的含C量高於每克葡萄糖的含C量。
計算方法
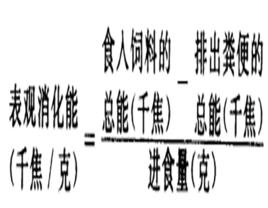
總能=糞能+消化能
消化能=尿能+甲烷能+代謝能
代謝能=熱增耗+淨能 (熱增耗過去又稱為特殊動力作用或食後增熱,是指絕食動物在採食飼料後短時間內,體內產熱高於絕食代謝產熱的那部分熱能。熱增耗以熱的形式散失。在冷應激環境中, 熱增耗是有益的,可用於維持體溫。但在炎熱條件下,熱增耗將成為動物的額外負擔,必須將其散失,以防止體溫升高;而散失熱增耗,又需消耗能量。 )
淨能=維持淨能+生產淨能
動物總產熱=維持淨能+熱增耗
物理學
在古典力學中,一個物理系統的總能量或稱總能,是其勢能(位能)與動能的和。所有的能量形式都可分類成此二類中的一者,總能可以等效地說是能從系統取得的理論性最大能量值。
在近代物理中,一個物理系統的總能是其靜能量、總動能及勢能的和,包括了系統內部狀態相關的內能。
總能的測定
測定原理
有機物的燃燒熱系單位質量有機化合物完全氧化時,所能釋放出的熱量,稱為該物質的燃燒熱,也稱總能。
根據熱力學第一定律,一個熱化學反應,只要其開始與終末狀態一定,則反應的熱效應就一定。這一原理使我們測定各種物質的燃燒熱變為有意義。有機物差不多均能氧化完全,並且反應進行很快,因此,準確地測定燃燒熱就有了可能。由所測得的燃燒熱還可以計算反應的熱效應和化合物的生成熱。
將由消化代謝試驗所用的飼料或日糧以及所收集的糞、尿樣品,製備成一定質量的測定試樣,裝於充有(25±5)kg·cm 純氧氧彈中進行燃燒。燃燒所產生之熱量為氧彈周圍已知質量的蒸餾水及熱量計整個體系所吸收,並由貝克曼溫度計讀出水溫上升的度數。該上升的溫度乘以熱量計體系和水的熱容量之和,即可得出試樣的燃燒熱。
在測定過程中一些因素會影響測定結果的準確性,須加以校正才可得出真實的熱價。例如,由於輻射的影響,水溫上升的度數與由燃燒產熱所致的實際升溫之間有偏差;引火絲本身燃燒的發熱量;以及含有氮、硫等元素的樣品,在氧化後生成硝酸、硫酸,其發熱量應予以扣除等。
儀器、試劑及必需品
儀器:
氧彈式熱量計(GR一3500型,長沙儀器廠),1套;氧氣鋼瓶(附氧氣表)及支架,1套;容量瓶2 000,1 000,200 mL,各1個;量筒200,500 mL,各1個;滴定管50 mL,1支;吸管10 mL,1支;燒杯250,500 mL,各1個。
試劑:
蒸餾水;苯甲酸(保證級試劑或分析純);0.1 mol/L碳酸鈉溶液(或0.1mol/L氫氧化鈉溶液);10 g/L甲基紅指示劑(或酚酞指示劑)。
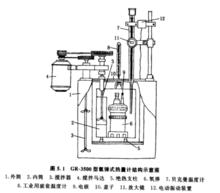
氧彈式熱量計結構簡介
氧彈式熱量計主要由氧彈、金屬內筒與外筒(即外用水槽)3部分組成。此外,還有攪拌器、引燃裝置、樣品壓樣機、彈頭座、氧氣表(附氧氣減壓閥)及氧氣過濾器等。
GR-3500型氧彈式熱量計結構示意圖如圖5.1所示:
 氧彈式熱量計
氧彈式熱量計對測熱室的要求
測熱工作應在恆溫條件下進行,否則所得結果將引入誤差。在沒有恆溫室的條件下最好選擇無窗的或北屋作測熱室。門窗應嚴密,室內避免陽光照射以及通風和暖氣的影響。要求儘可能使室溫變動不大。當儀器新搬入室內時,應放置適當時間,待儀器溫度與室溫平衡時,方可開始試驗工作。
操作步驟
1.準備工作:
測定前應擦淨氧彈各部污物及油漬,以防試驗時發生危險,氧氣鋼瓶應置於陰涼安全處,並應注意避免滑倒。
(1)稱量樣品及引火絲的準備。取1~1.5 g風於飼料樣品(經粉碎過40目篩),用壓樣機壓成餅狀,然後置於乾燥潔淨的坩堝中稱重(準確至0.000 1 g)。樣品的多少依測定時溫度上升不高於3~4℃為準,最好以1℃左右為宜。如溫差大時,熱量計因輻射而損失的熱也多,引起的誤差也較大。此外,在稱量樣品的同時,應測定樣品的含水量,以便換算成絕乾基礎的熱價。量取及稱重10 cm的引火絲,將盛有樣品的坩堝置於彈頭的坩堝支架上,將引火絲固定在兩個電極之上,其中一端應距樣品表面1~2 mm。引火絲切勿接觸坩堝。
(2)加水及充氧。在彈頭與彈體裝配前,取5~10 mL水注入氧彈底部,以吸收燃燒過程中產生的五氧化二氮與三氧化硫氣體。加入的水量不要求很精確,但應與測定熱量計水當量相一致。然後用螺帽將彈頭與彈體扭緊,取下進氣閥的螺母,擰上連線氧氣瓶的氣管接頭,充氧之前應先打開針形閥。先充氧約5 kg·cm ,使氧彈中空氣排盡。然後,充氧壓力應逐漸增至25~30 kg·cm 。但充氧不可過快,否則會使坩堝中的試樣為氣流所衝散而損失。這一點必須注意。
(3)內外水筒的準備及熱量計的安裝。從外筒的注水口加人水至離上緣1.5 cm處止,為防止水中雜質的沉澱,套用蒸餾水。外筒灌水後可用攪拌器攪拌(外筒水不須經常更換),待水溫與室溫一致時,才能使用。如熱量計長期不用,應將水套中的水全部放出乾燥保存。熱量計內筒的蒸餾水應蓋過氧彈進氣閥螺母2/3高度。各套儀器的水量不同,2 000~3 000 g。國產GR-3500型熱量計的加水量為3 000 g,每次稱量應相等,準確至0.1~0.5 g(如不具備稱量條件,可用容量瓶量取2 000-3 000 mL蒸餾水)。為減少輻射,測定前應調節內筒水溫使低於外筒水溫,GR-3500型以0.5~0.7℃為宜,其他型號在1~1.5℃之間(試樣發熱量少時,可相差0.5℃)。內筒灌水應在內筒放人外筒,並將氧彈放入內筒後才可進行。灌注時注意勿使水濺出,以免影響數值的準確性。
氧彈在內筒中應放置適當的位置,勿使攪拌器的葉片與內筒或氧彈接觸,然後將貝克曼溫度計固定於支架上,使其水銀球中心位於氧彈一半高度的位置,最後蓋上蓋子。
整個熱量計準備就緒後,才可開動攪拌器,為保證測定時攪拌所生的熱大致相等。攪拌器的速度變化,不得超過10%。攪拌速度可由控制箱上的旋鈕加以調節。
2.測定工作
全部測定工作分為3期:燃燒前期(即初期)、燃燒期(即主期)及燃燒後期(即末期)。
(1)燃燒前期(初期)是燃燒之前的階段,用以了解熱由外筒傳人內筒的速度。攪拌器開動3~5 min後,開始記錄溫度,每分鐘1次。當每分鐘溫度上升幾乎恆定時,可定為初期的起點,也即試驗的開始點(定為0點)。然後,每隔1 min讀記1次溫度,如此連續5~10 min。讀溫度應精確至0.001℃。
(2)燃燒前期之末按電鈕點火(此時定為a點),燃燒前期最後1次讀溫,也就是燃燒期(主期)的第一次讀溫。燃燒期(主期)內每0.5 min記錄1次,直至溫度不再上升為止(此時為c點),燃燒即行結束。使用的點火電壓約為24 V,由於點火而進入熱量計體系的電熱通常可忽略。但通電流的時間每次都應相同,不應超過2 S。如通電時間過久,則因點火而產生的熱會影響測定結果的精確度。
(3)燃燒後期(末期)。燃燒期結束即為燃燒後期(末期)的開始。其目的在測定熱由內筒傳向外筒的速度,亦須每分鐘讀記溫度1次,至每分鐘溫度變化不大時為止,需5~10 min。燃燒後期的終點,即為全部試驗期的結束(定為d點)。
3.結束工作
測定溫度後,停止攪拌器。首先取下溫度計,然後從內筒取出攪拌器及氧彈。氧彈應靜置30 min,使能溶解的氣體完全溶解。然後將排氣口打開,使氧彈中剩餘的氧氣和二氧化碳在5~10 min徐徐排出。擰開螺帽,取出彈頭,如氧彈內有黑煙或未燃盡的試樣,則這個試驗應作廢。如燃燒成功,則小心取出燒剩的引火絲,精確測量其長度或質量。用熱蒸餾水仔細沖洗氧彈內壁、坩堝及進氣閥、導氣管等各部分,洗液及燃燒後的灰分移人潔淨的燒杯中,供測定酸與硫的含量,以校正酸的生成熱。在一般情況下,由於酸的生成熱很小,約為4 J,因此常忽略不計。
氧彈、內筒、攪拌器在使用後套用紗布擦乾淨。各塞門應保持不關閉狀態,並用熱風將其接觸部分吹乾,防止塞門生鏽而不能密閉而漏氣。
每次燃燒結束後,應清除坩堝中的殘餘物。普通坩堝可置於高溫電爐中,加熱至600℃維持3~4 min,燃去可能存在的污物及水分。白金坩堝可在稀鹽酸中煮沸,也可用氟氫酸稍加熱以去污,石英坩堝只能擦拭,因加熱與用氟氫酸處理,都對石英有損。
總能的計算
總能計算公式如下:
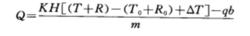 計算公式
計算公式式中:Q為飼料或糞、尿樣品的燃燒熱;K為熱量計的水當量;T為主期階段最終溫度;T為主期階段最初溫度;R為在T溫度計刻度的校正值;R為在T時溫度計刻度的校正值;H為用貝克曼溫度計時,溫度計上每一刻度相當於實際溫度值;m為試樣的質量;△T為熱量計與周圍空氣的熱交換校正值;b為點火絲的質量;q為點火絲的熱值。
樣品兩次平行測定結果允許相差不超過0.13 kJ/g。
點火絲熱值:鐵絲,6.69 kJ/g;鎳絲,3.24 kJ/g;銅絲,2.51 kJ/g鉛絲,0.42 kJ/g。
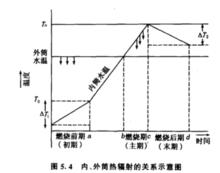
(1)熱交換校正值△T計算。在熱量測定過程中,外筒水溫與室溫平衡,應保持其恆定不變。內筒水溫低於外筒1~1.5 ℃,在點火燃燒以前,熱由外筒向內筒輻射。點火燃燒之後,內筒溫度上升超過外筒溫度後,熱由內筒向外輻射。由於此種輻射的影響,觀察的溫度需要校正。測定過程中內、外筒熱輻射的關係如圖5.4所示:
 內外筒熱能關係圖
內外筒熱能關係圖△T為輻射熱的校正值,可套用奔特氏公式來計算。奔特氏公式如下:
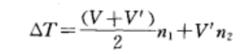 公式
公式式中:y為初期階段每0.5min溫度平均變化(負值)(以10次為準);V7為末勢階段每0.5min溫度平均變化(正值)(以10次為準);咒,為主期階段中甘速升溫0.5min次數(每0.5 min溫度上升大於0.3℃);咒2為主期階段峙慢速升溫0.5min次數(每0.5 min溫度上升小於0.3℃)。
奔特氏公式的依據:當點火燃燒之初,內筒水溫迅速上升時,熱量計體系j}|環境(外筒水溫)之間熱交換速度相當於燃燒前期和後期溫度變化速度的算術耳均數,即(V+V')/2。而當溫度上升較慢時,則相當於燃燒後期的冷卻速度,即V,V'以10次為準,便於計算。
(2)熱量計的水當量。儀器(整個體系)的熱容量(包括氧彈、攪拌器、內筒、疆度計以及輻射損失部分等),為了在計算上方便,用相當於水的質量(g)來表示即使儀器體系溫度上升1 C所需的熱量,能使多少克水溫上升1℃,故又稱水蘭量。因為儀器的熱容量也是隨環境溫度而變化的,因此儀器的熱容量或水當量才是恆定不變的常數。故在測定飼料或其他試樣的熱價時,須先測知在該環境溫壓下儀器的熱容量。
熱量計的水當量測定方法與測定飼料燃燒熱的方法相同,只是用一定質重的已知熱價的純有機化合物來代替飼料試樣,例如可採用苯甲酸、水楊酸等,其中苯甲酸為最常用。苯甲酸應先經研細,放置在盛有濃硫酸的乾燥器中3 d後使用。也可放在121~126℃的烘箱中乾燥1 h,再放在乾燥器中冷卻使用。如果表面出現針狀結晶,套用小刷刷掉,以防燃燒不完全。常用有機化合物的熱價。
另外,測定熱量計的水當量時,除了需要扣除引火絲本身燃燒發熱量外,還需要校正其他來源的熱量,如酸的生成熱及其在水中的溶解熱,以及因含硫不同而產生的不同硫酸生成熱。上述各項熱量必須從飼料燃燒熱中扣除。一般情況下只校正酸的生成熱和溶解熱,其他可略去不計。