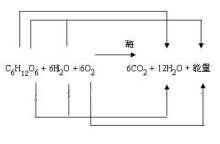
普通乾電池的總反應為:2Zn+4NH4Cl+4MnO2=〔Zn(NH3)4〕Cl2+ZnCl2+2Mn2O3+2H2O
電極反應式是指:電化學反應中,原電池放電時的正、負極或電解池電解時的陰、陽極,發生的還原、氧化反應得失電子的離子反應式,包括極區溶液中的微粒參加的反應在內。即電極反應式=放電反應+環境反應
總反應式則有兩個層次的含義。廣義的總反應式是指原電池放電(或電解池電解)時裝置中所發生的所有相關化學變化並反映各物質之間的化學計量關係的總反應式(既包括兩極反應又包括兩極反應的產物在溶液中的相關反應)。而狹義的總反應式僅是指兩電極反應式之和,不包括兩極的電極反應產物在溶液中相遇或混勻溶液時發生的反應。即總反應式=電極反應之和+環境中的相遇反應
例如:普通的鋅錳乾電池的電極反應式和總反應式如下:
正極:2NH4++2e-+2MnO2=2NH3+Mn2O3+H2O
(包括極區反應H2+2MnO2=Mn2O3+H2O,教材此處已在試用版的基礎上得到修正)
負極:Zn-2e-=Zn2+
該電池總反應式為(狹義):Zn+2NH4++2MnO2=Zn2++2NH3+Mn2O3+H2O(一般常用此式表示)
若還包括兩極各自產物Zn2+和NH3在溶液中的絡合反應{Zn2++4NH3=[Zn(NH3)4]2+},則該電池反應的總反應式(廣義)即為:2Zn+4NH4++4MnO2=Zn2++[Zn(NH3)4]2++2Mn2O3+2H2O。
二、電極反應式和總反應式的書寫規則
1、電極反應式的書寫規則
(1)電極反應式中各微粒的化學式均嚴格按照離子方程式的書寫規則進行書寫(即除了易溶且易電離的物質才可拆成離子形式,其它物質一律只寫成化學式)。
(2)加和性。電極反應式不僅寫出被氧化和被還原的物質及其產物外,還須包括該極區周圍電解質溶
液中參加了離子反應的微粒在內。(注意:鹽類的水解程度一般很小,因此可不考慮某些離子的水解反應)(3)原子守衡,電荷守恆,得失守恆
例1:氫氧燃料電池:(1)在KOH溶液的強鹼性介質中
負極:2H2-4e-+4OH-=4H2O
↑↑
(被氧化物質)(負極區溶液中的OH-和氧化產物H+反應)
正極:O2+4e-+2H2O=4OH-
↑↑
(被還原物質)(正極區溶液中的H2O和還原產物反應)
(2)在鹽酸的強酸性介質中
負極:2H2-4e-=4H+
正極:O2+4e-+4H+=2H2O
↑↑
(被還原物質)(正極區溶液中的H+和還原產物反應)
例2:用惰性電極電解
(1)Na2SO4溶液:
陽極:2H2O-4e-=4H++O2↑(導致陽極區周圍溶液呈酸性)
陰極:4H2O+4e-=2H2↑+4OH-(導致陰極區周圍溶液呈鹼性)
(當溶液中陽極產物H+和陰極產物OH-在溶液中相遇發生反應H++OH-=H2O,最終溶液呈中性)
(2)H2SO4溶液:
陽極:2H2O-4e-=4H++O2↑
陰極:4H++4e-=2H2↑
2、總反應式的書寫規則
(1)將原電池放電時的正、負兩極(或電解時的陰、陽兩極)的電極反應式相加所得的和即為總反應式(這裡系指狹義的總反應式)。
(2)電解質溶液中來自兩極的電極反應所分別產生的離子,在溶液中相向遷移,相遇並相互發生的離子反應,可單獨書寫離子方程式,當然也可寫入總反應式而得到廣義的總反應式(由於這些離子反應的化學計量數關係和電極反應式是一致的)。
上述例1的電池總反應式均為:2H2+O2=2H2O;
而例2的廣義總反應式均為:2H2O=2H2↑+O2↑
(3)以上所得的總反應式一般為離子方程式,也可改寫成對應的化學方程式。