警示語
警告:由於鹽酸米多君可造成臥位血壓的顯著升高,因此它僅用於在臨床護理後其生活仍受到嚴重干擾的患者。在治療出現症狀的體位性低血壓時,使用鹽酸米多君的指征主要通過客觀指標而體現,即立位1分鐘檢測血壓,如收縮壓升高則說明患者從治療中獲益,但其對患者日常生活能力方面的改善尚未得到充分證實。
成份
 管通
管通本品主要成份:鹽酸米多君
化學名稱:1-(2,5-二甲氧苯基)-2-甘氨醯胺-乙醇-(1)-鹽酸
化學結構式:
分子式:CHNOCl
分子量:290.75
性狀
本品為白色片。
適應症
用於治療體位性低血壓。僅用於臨床護理後其生活仍受到嚴重干擾者,包括非藥物治療(如醫用輔助襪)、擴容和改變生活方式等。
女性壓力性尿失禁。
規格
片劑,每片2.5mg。
用法用量
低血壓:根據病人自主神經的張力和反應性進行治療並作相應的調整。建議用以下劑量:=成人和青少年(12歲以上):開始劑量2.5mg(1片)每日2-3次。根據病人的反應和對此藥的耐受能力,可間隔3-4天增加一次劑量,達到每次10mg,每日3次。本品應當在白天、病人需要起立進行日常活動時服用。每4小時間隔的服藥時間推薦如下:晨起直立或晨起直立前,中午,和下午晚些時候(通常不遲於下午6點)。如需要,也可每間隔3小時給藥以控制症狀,但不宜經常如此。一次給予單劑量20mg者,出現嚴重而持久的臥位高血壓發生率較高(約45%)。部分患者雖可耐受超過30mg的每日劑量,但其安全性和有效性尚缺乏系統的研究或確認。
由於有引起臥位高血壓的危險,本品僅在初次治療後症狀明顯改善的患者中使用,並應經常監測臥位和立位血壓變化,如臥位血壓過分升高,應停止使用本品。
因脫甘氨酸米多君經腎臟排泄,腎功能異常的患者應慎用;儘管還缺乏系統的研究,這類患者開始使用本品的推薦劑量為2.5mg。
尿失禁:成人每次2.5mg(1片)至5mg(2片),每日2-3次,通常每天劑量不超過10mg,可在有經驗的醫生指導下,根據病人情況調整劑量。
為防止臥位高血壓,不應在晚餐後或就寢前4小時內服用鹽酸米多君片。
不良反應
 管通
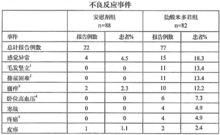
管通在有安慰劑對照的臨床試驗中,常見的不良反應有:臥位和坐位時的高血壓,主要發生於頭皮的感覺異常和瘙癢,皮膚豎毛反應(雞皮疙瘩),寒戰,尿失禁,尿瀦留和尿頻。
3周的安慰劑對照試驗中,上述事件的發生見下表。
1 包括過敏和頭皮感覺異常
2 包括排尿困難(1)、尿頻(2)、排尿障礙(1)、尿瀦留(5)、尿急(2)
3 包括頭皮瘙癢
4 包括出現臥位高血壓的患者
5 包括腹痛和疼痛加劇
少見的不良反應有:頭痛,頭脹,面部血管擴張,臉紅,思維錯亂,口乾,神經質/焦慮及皮疹。偶發的不良反應有:視野缺損,眩暈,皮膚過敏,失眠,嗜睡,多形性紅班,口瘡,皮膚乾燥,排尿障礙,乏力,背痛,心口灼熱;噁心;胃腸不適;胃腸脹氣及腿痛性痙攣。
鹽酸米多君治療中最可能的嚴重不良反應為臥位高血壓。感覺異常、皮膚瘙癢、豎毛和寒戰等毛髮運動反應,與鹽酸米多君對毛囊上α-腎上腺素能受體的作用有關。尿頻、尿急和尿瀦留與鹽酸米多君對膀胱頸α受體的作用有關。
禁忌
本品禁用於嚴重器質性心臟病,急性腎臟疾病,嗜鉻細胞瘤或甲狀腺功能亢進的患者。持續性臥位高血壓患者和過高的臥位高血壓患者不應使用本品。
注意事項
本品治療開始前應對患者可能的臥位和坐位高血壓情況進行評估。通常禁止患者完全平躺,即可預防臥位高血壓的發生,即睡覺時採用頭高位。患者應警惕並及時報告臥位高血壓症狀。其主要症狀包括心臟抨擊感、耳邊衝擊感、頭痛、視力模糊等。如臥位高血壓持續存在,患者應迅速停止用藥。
本品與其它血管活性藥物,如苯腎上腺素、麻黃素、雙氫麥角胺、苯丙醇胺或偽麻黃鹼等合用時,應嚴密監測血壓變化。
服用本品後可能導致輕度心率減緩,主要是迷走神經反射引起。應慎重考慮本品與強心苷(如洋地黃)、精神類藥物、β-受體阻滯劑或其它直接或間接降低心率的藥物的聯合套用。用藥後出現心動過緩症狀和體徵的患者(脈搏變緩、頭暈加重、暈厥、心臟抨擊感),應考慮停止用藥並重新評估病情。
尿瀦留患者應慎用本品,因為脫甘氨酸米多君能作用於膀胱頸的α-腎上腺素能受體。合併糖尿病的體位性低血壓患者應慎用本品;因視力障礙而服用氟氫可的松的患者,也應慎用本品,因為氟氫可的松可導致眼壓增高和青光眼。
關於本品套用於腎功能損害的患者尚無研究報導。脫甘氨酸米多君主要通過腎臟清除,這類患者可能出現藥物積聚,因此腎功能損害患者應慎用本品,初始劑量應以2.5mg為宜(參見用法用量),在開始用藥前應充分評估腎臟功能。
尚未研究肝功能損害的患者套用本品的情況。考慮到米多君通過肝臟代謝,肝功能損害患者應慎用本品。
某些非處方藥物(OTC藥物),如感冒藥、減肥藥可能會升高血壓,因此與鹽酸米多君合用時需要考慮到藥物的協同作用。(參見藥物相互作用)。應當告知患者發生臥位高血壓的可能性,無論臥位時間長短,均應避免服用本品,患者應在睡前3-4個小時最後一次服用本品,以減少夜間臥位高血壓的情況出現。
孕婦及哺乳期婦女用藥
妊娠:本品可增加大鼠和家兔的胚胎吸收率,降低胎兒體重,按照體表面積計算,給予人類最大劑量13倍(大鼠)和7倍(家兔)劑量後,家兔胚胎的存活率降低。目前尚缺乏針對孕婦的相關研究。妊娠期套用本品時,須充分權衡其對胎兒的潛在益處大於潛在危險。對大鼠和家兔的研究未見其致畸作用。
哺乳期婦女:尚不清楚本品是否可分泌到母乳中。哺乳期婦女應謹慎使用本品。
兒童用藥
尚未確定兒童患者使用本品的安全性和有效性。
老年用藥
65歲或年齡更比者與小於65歲的患者比較,男性和女性患者比較,米多君和脫甘氰酸米多君的血藥濃度均相似,所以無需調整推薦劑量。
藥物相互作用
強心苷與本品同時使用時,可能導致心動過緩、房室傳導阻滯或心律失常。
α-腎上腺素能受體激動劑(如苯腎上腺素、右旋麻黃鹼、麻黃素、苯丙醇胺)可能增強本品的升壓效應。因此,當本品與其他引起血管收縮的藥物合用時,應予慎重考慮。
對已經使用鹽皮質類固醇(如氟氫可的松醋酸鹽)治療、同時需要套用米多君的病例,同時補充或未補充鹽分。須監控血壓謹防發生臥位高血壓,在本品治療前,可降低氟氫可的松劑量,或降低鹽的攝入,以降低臥位高血壓的發生率。α-腎上腺素能阻滯藥物,如哌唑嗪,特拉唑嗪和多沙唑嗪能拮抗本品的作用。
潛在的藥物相互作用:脫甘氨酸米多君具有較高的腎清除率,這可能與腎小管對鹼基的主動分泌功能有關。腎小管的這一功能也與二甲雙胍、西米替丁、雷尼替丁、普魯卡因胺、氨苯蝶啶、氟卡胺和奎尼丁的分泌有關。因此本品很可能與這些藥物存在藥物問的相互作用。但這種推測尚無確切的試驗數據支持。
藥物過量
用藥過量的症狀包括高血壓、豎毛(雞皮疙瘩),畏寒和尿瀦留。有兩例過量服用本品的報告,均為年輕男性患者。一例服用鹽酸米多君250mg滴劑後,收縮壓超過200mmHg,給予靜脈注射20mg酚妥拉明處理,當日出院後未訴不適。另一例服用205mg鹽酸米多君(5mg片劑共41片)後,出現嗜睡、不能說話,對聲音無應答、儀對疼痛刺激有反應、高血壓,經洗胃處理後,患者第二天完全恢復,無後遺症。尚不清楚能出現用藥過量症狀或危及生命安全的單一劑量數值。
口服劑量的LD為:大鼠約30~50mg/kg,小鼠675mg/mg,狗125~160mg/kg。
脫甘氨酸米多君可被透析出。
基於此藥的藥理學特性,過量後的一般處理方法包括誘導嘔吐,和使用α交感神經阻斷劑(如酚妥拉明)。
藥理毒理
作用機制:本品在體內形成活性代謝物— 脫甘氨酸米多君,後者為α腎上腺素受體激動劑,可通過興奮動脈和靜脈α腎上腺素受體而使血管收縮,進而升高血壓。脫甘氨酸米多君不會激動心臟β-腎上腺素受體,且基本不能透過血-腦屏障,因而不會影響中樞神經系統的功能。
各種原因導致的體位性低血壓患者服用本品後,其立位、坐位和臥位的收縮壓和舒張壓均可升高。服用米多君10mg後1小時,立位收縮壓升高約15-30mmHg,某些患者療效持續2到3小時。對自主神經衰竭患者,本品不影響其立位和臥位的脈率。
致癌作用、誘變、生育力損害:在一項對大鼠和小鼠的長期研究中,按人類最大推薦劑量3~4倍劑量給藥(按體表面積mg/m2計算),未發現本品有致癌效應。在本品致突變的研究中未見其有致突變性。對雄性小鼠致死後的研究中,未觀察到其對生育力的損害。尚未進行本品對生育力影響的其它研究。
藥代動力學
本品是一種前體藥物,口服米多君後的藥物作用取決於其活性代謝產物—脫甘氨酸米多君的體內濃度。本品口服後吸收迅速,血中前體藥物達峰時間約30分鐘,半衰期約25分鐘;活性代謝產物達峰時間約1-2小時,半衰期約3-4小時。米多君的絕對生物利用度(檢測脫甘氨酸米多君水平)為93%,生物利用度不受食物的影響。口服和靜脈用藥後形成的脫甘氨酸米多君數最相近。米多君或脫甘氟酸米多君蛋白結合率均較低。
現有研究發現,許多組織能將米多君脫甘氨酸而形成脫甘氨酸米多君,這兩種產物均從肝臟部分代謝。米多君和脫甘氨酸米多君都不是單胺氧化酶的底物。米多君腎臟排泄量極少。脫甘氨酸米多君的腎臟清除率約為385毫升/分,大部分約80%通過腎小管的主動分泌功能排泄,尚不清楚選種主動分泌的作用機制,但可能是通過鹼基分泌通路,此通路也負責其他鹼基藥物的分泌(參見潛在的藥物相互作用)。
貯藏
必須低於25℃,避光,乾燥處保存。
包裝
鋁箔包裝,每盒10片,20片。
有效期
24個月
執行標準
進口藥品註冊標準JX20070127
生產企業
奈科明(奧地利)有限公司
核准日期
2007年3月7日
修訂日期
2008年7月28日

