成份
 盧美根
盧美根本品主要成份為貝美前列素。
化學名稱:
(Z)-7-[(1R, 2R, 3R, 5S)-3,5-二羥基-2-[(1E, 3S)-3-羥基-5-苯基-1-戊烯基]環戊基]-5-N-乙基庚烯醯胺
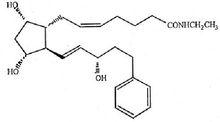
其結構式為:
分子式:CHNO
分子量:415.58
每毫升含:貝美前列素0.3mg,氯化鈉8.3mg,苯扎氯銨0.05mg,磷酸氫二鈉,枸櫞酸,氫氧化鈉和域鹽酸調節pH值及純水。
性狀
本品為無色澄明液體。
適應症
本品用於降低開角型青光眼及高眼壓症患者的眼壓。
規格
0.03%
用法用量
推薦劑量為每日一次,每晚滴一滴於患眼。每日使用本品的次數不得超過一次,因為有資料表明頻繁使用本品可導致其降眼壓效果減弱。
首次滴用本品約4小時後眼內壓開始降低,約於8~12小時之內作用達到最大。
本品可以與其他滴眼劑同時使用以降低眼內壓。如果同時使用多種 治療藥物,則每兩種藥物的使用應至少間隔五分鐘。
不良反應
臨床試驗中,有15%到45%的患者使用本品曾分別出現不良事件,最常 見的不良事件按發生的幾率降序排列為:結膜充血、睫毛增生、眼部瘙癢。大約有3%的患者因結膜充血而中斷治療。
有3%到10%的患者曾出現如下的眼部不良事件,按發生的幾率降序排列為:眼睛乾澀、視覺障礙、眼部燒灼感、異物感、眼睛痛、眼周皮膚色素沉著、瞼緣炎、白內障、淺層點狀角膜炎、眼瞼紅斑、眼部刺激和睫毛顏色變深。據報導約有1%到3%的患者曾有如下的不良事件,按發生的幾率降序排列為:眼睛分泌物、流淚、畏光、過敏性結膜炎、視疲勞、虹膜色素沉著增加和結膜水腫。報導有不到1%的患者曾出現眼內炎症,如虹膜炎。
據報導約有10%的患者出現的全身性不良事件為感染(主要為感冒和上呼吸道感染)。有1%到5%的患者曾出現下述全身性不良事件,按發生幾率降序排列為:頭痛、肝功能異常、乏力和多毛症。
禁忌
本品禁用於對貝美前列素或本品中其他任何成份過敏者。
注意事項
一般情況:本品可能逐漸增加虹膜的色素沉著(參見警告)。眼睛顏色的改變是因為黑色 素細胞中的黑色素增多,而不是黑色素細胞數量的增加。這種變化可能在數月至數年內 都不明顯。典型的褐色素沉著以瞳孔為中心向外圍擴散,且整個虹膜或部分虹膜的褐色 也會加深。虹膜上的痣和斑點不受治療的影響。對於虹膜色素沉著顯著增加的患者可以 繼續用本品治療,但應定期進行檢查。
在臨床研究中,停止用藥後虹膜的褐色素不會再增加,但已改變的顏色可能是永久性的。
已有報導,與使用本品有關的眼瞼皮膚顏色加深在治療停止後可能是可逆的。
使用本品可能逐漸改變治療眼的睫毛和毳毛-包括長度、濃密度和數量的增加。治療停止後睫毛的變化通常是可逆的。
患有活動性內眼炎症(如葡萄膜炎)的患者須慎用本品。
曾有報導,有患者使用本品後出現了黃斑水腫包括囊樣黃斑水腫。無晶狀體患者,晶狀體後囊撕裂的假性無晶狀體患者或已知有黃斑水腫危險的患者應慎用本品。
尚無本品治療閉角型、炎性及出血性青光眼的研究資料。
有報導患者因使用多劑量包裝的滴眼液而致細菌性角膜炎。大多數情況下,包裝容器的污染是由於患者同時患有角膜疾病或眼睛上皮表面破裂所致。
—在使用本品前需將隱形眼鏡摘去,且使用15分鐘後才可再佩戴。
患者須知:應告知患者有發生虹膜褐色色素沉著增加的可能性,並且可能是永久性的。還應告知患者可能會出現眼瞼皮膚顏色加深,但在停止使用本品後可能是可逆的。
患者應被告知使用本品可能會使治療眼的睫毛和毳毛逐漸改變。這些變化可能導致雙眼睫毛長度,豐滿度.色素沉著、睫毛或毳毛數量和或睫毛生長趨勢的不對稱。停止治療一後這些睫毛改變通常是可逆的。
患者應該被告知勿將藥瓶的瓶口直接接觸眼睛,眼周組織,手指以及其他物體的表面,以免藥液被可致眼睛感染的細菌污染。使用被污染的藥液會嚴重損傷眼睛進而使視力下降。
患者應該被告知在使用過程中,若眼部出現任何狀況(如外傷或感染)或進行眼科手術,應立即諮詢醫生是否可以繼續使用此多劑量包裝的滴眼液。
患者應該被告知在使用過程中,若眼部出現反應,特別是結膜炎和眼瞼反應時應及時諮詢醫生。
應告訴患者本品中含有的苯扎氯銨會被軟性隱形眼鏡吸收。使用本品前應當摘下隱形眼鏡,並在滴藥15分鐘後再配戴。
如果同時還使用其他眼用製劑,每兩種藥物的使用至少應間隔五分鐘。
孕婦及哺乳期婦女用藥
孕婦:對妊娠期的婦女使用本品還缺少足夠有良好對照的研究。因為動物的生殖試驗還不能直接預見人類的反應。僅當使用本品的益處遠遠大於其帶給胎兒的危險性時,方可給孕婦使用。
哺乳期婦女:雖然動物試驗表明動物的乳汁中分泌有貝美前列素,但本品是否會從人類乳汁中分泌還不清楚。由於許多藥物都會分泌入乳汁中,因此給哺乳期婦女使用本品應謹慎。
兒童用藥
兒童患者使用本品的安全性和有效性尚未確立。
老年用藥
使用本品的安全性和有效性在老年人和成年人之間沒有明顯的臨 床差異。
藥物相互作用
本品可以與其他滴眼劑同時使用以降低眼內壓。如果同時使用多種治療藥物,則每兩種藥物的使用應至少間隔五分鐘。
藥物過量
沒有關於人體使用本品過量的資料報導。如果過量使用了本品,應該根據出現的症狀進行相應處理。
臨床試驗
對平均基線眼壓水平為26mmHg的開角型青光眼患者和高眼壓症患者進行的臨床研究顯示,每天滴一次(晚上)本品,可以降低眼壓7-8 mmHg。
使用此類藥物產品5年的研究結果顯示,大多數患者在治療的第一年內出現了明顯的虹膜色素沉著增加。在5年的研究期間,患者虹膜色素沉著持續增加。這種虹膜色素沉著的增加對研究中所報告的不良事件(除虹膜色素增加之外)的發生率、性質或嚴重程度都沒有影響。研究期間IOP的降低也與虹膜色素增加無關。
有肝病史或ALT.AsT和\或膽紅素基線值異常的患者,使用本品48個月對其肝功能無不良影響。
藥理毒理
藥理作用:貝美前列素為一種合成的前列醯胺,是具有降低眼內壓活性的前列腺素結構類似物,選擇性地模擬了天然存在的前列醯胺的作用。貝美前列素被認為是通過增加房水經小梁網及葡萄膜鞏膜兩條外流途徑而降低眼內壓(IOP)的。高眼壓是導致青光眼性視野缺損的主要因素。眼內壓越高,視神經受損及視野缺損的危險性越大。
毒理作用:在小鼠和大鼠的口服(管飼)試驗中,即使給藥劑量達到100mg /kg/天時仍無毒性反應。此劑量以mg/m2表示至少比體重為十公斤 的小孩用一整瓶本品的劑量高70倍。
致癌,致突變,生殖毒性:對小鼠或大鼠分別口服餵飼104周,劑量達2mg/kg/天和1mg/kg/天(相當於約192和291倍人體推薦用量,以局部角膜和/或結膜囊給藥後血液AUC水平計)的研究中,貝美前列素沒有致癌性。
艾姆斯氏試驗,小鼠淋巴瘤試驗和小鼠體內微核試驗顯示貝美前列素無致突變作用。
在用雌性和雄性大鼠進行的試驗中,當給藥劑量達到0.6mg/kg/天 (以血液AUC水平計,相當於人體推薦用藥量的103倍)時也不損害其生殖能力。
致畸作用:對懷孕小鼠和大鼠進行的胚胎/胎鼠發育研究,給小鼠和大鼠分別口服以血液AUC水平計至少相當於人體推薦用藥量的33和97倍劑量的貝美前列素,妊娠的小鼠和大鼠發生流產。
當給藥劑量為以血液AUC水平計相當人體推薦用藥量的41倍時,母鼠妊娠期縮短,死胎、再吸收推遲現象增加,分娩前後幼鼠死亡率增加且幼鼠體重減輕。
藥代動力學
吸收:給15名健康受試者雙眼每天一次,每次各一滴本品,連續2周,給藥後 10分鐘內藥物達到血藥濃度峰值,且大多數受試者給藥後1.5個小時內血藥濃度降至檢測限(0.025ng/ml)以下。第7天和第14天時的Cmax 和AUC0-24hr的平均值相似,分別約為 0.08ng/ml,0.09ng×hr/ml,表 明藥物在給藥後的第1周就達到了穩態。貝美前列素無明顯全身蓄積現象。
分布:貝美前列素以中等速度分布到體內的各組織中,穩態分布容積為0.67L/kg。人血中,貝美前列素主要分布在血漿中。約有12%的貝美前列素游離存在於血漿中。
代謝:貝美前列素通過眼部給藥進入全身循環系統後,主要以原形的形式進行循環。之後通過氧化、N-去乙基化和葡萄糖醛酸化生成 不同的代謝物。
消除:給6名健康受試者靜脈注射放射性標記的貝美前列素(3.12mg/ kg),原形藥物的最大血藥濃度為12.2ng/ml,之後以消除半衰期為45分鐘的速度迅速減少。貝美前列素的血液總清除率1.5L/hr/kg。近67%的藥物通過尿液排出,25% 的藥物可以在糞便中回收。
貯藏
保持包裝完整,貯存於2~25℃。
包裝
塑膠滴瓶裝無菌眼藥水,1支/盒
(1)3ml:0.9mg (2)5ml:1.5mg
有效期
24個月
執行標準
JX20100170
生產企業
Allergan, Inc.
核准日期
2006年10月27日
修訂日期
2010年10月19日
