簡介
熱化學式,又名熱化學方程式(thermochemical equation)是用以表示化學反應中的能量變化和物質變化。熱化學方程式的意義為熱化學方程式不僅表明了一個反應中的反應物和生成物,還表明了一定量物質在反應中所放出或吸收的熱量。
定義
熱化學方程式是表示化學反應中的物質變化和焓變(或能量變化;熱量變化)。
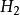 熱化學式
熱化學式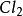 熱化學式
熱化學式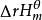 熱化學式
熱化學式例如,熱化學方程式:(g) + (g) = 2HCl(g) = -183 kJ/mol
 熱化學式
熱化學式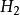 熱化學式
熱化學式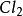 熱化學式
熱化學式方程的意義是在標準態時,1mol (g)和1mol (g)完全反應生成2mol HCl(g),反應放熱183kJ。
熱化學方程式代表著一個假想的過程,實際反應中反應物的投料量比所需量要多,只是過量反應物的狀態沒有發生變化,即使是一個無法全部完成的反應,也不會因此影響反應的反應熱。
書寫事項
書寫和套用熱化學方程式時必須注意以下幾點:
(1)反應熱與溫度和壓強等測定條件有關,所以書寫時指明反應時的溫度和壓強,若是標準狀態下,即溫度為25℃(298.15K)、氣壓為101kPa時,可以不註明。
(2)各物質化學式右側用圓括弧()表明物質的聚集狀態。可以用g、l、s分別代表氣態、液態、固態。固體有不同晶態(同素異形體)時,還需將晶態(形)註明,例如S(斜方),S(單斜);C(石墨),C(金剛石)等。溶液中的反應物質,則須註明其濃度,以aq代表水溶液,(aq,∞) 代表無限稀釋水溶液。
(3)熱化學方程式中化學計量數隻表示該物質的物質的量,不表示物質分子個數或原子個數,因此,它可以是整數,也可以是分數。
(4)△H只能寫在化學方程式的右邊,若為放熱反應,則△H為“-”;若為吸熱反應,則△H為“+”。其單位一般為kJ/mol,有時也用J/mol。
(5)熱化學方程式是表示反應已完成的數量。由於△H與反應完成物質的量有關,所以方程式中化學式前面的化學計量數必須與△H相對應,當反應逆向進行時,其反應熱與正反應的反應熱數值相等,符號相反。
(6)不標註氣體上升符號和沉澱符號,即“↑”或“↓”。
(7)熱化學方程式無需書寫如△(加熱)和催化劑的反應條件。
(8)即使是有機熱化學方程式或可逆反應也用等號“=”,不用箭頭和可逆符號“→”,“⇌”。
(9)反應熱可分為多種,如燃燒熱、中和熱、溶解熱等,在25℃,100kPa時,(舊的標準態壓力為1 atm=101 kPa,即1標準大氣壓,新的標準態壓力改為1 bar=100 kPa。1 mol純物質完全燃燒生成穩定的化合物時所放出的熱量,叫做該物質的燃燒熱.單位為kJ/mol
(10)在稀溶液中,酸跟鹼發生中和反應生成1mol水時的反應熱叫中和熱。書寫中和熱的化學方程式應以生成1mol水為基準。
(11)同一化學反應,隨著化學計量數改變△H的值而改變。若化學計量數相同,當反應物、生成物狀態不同時,△H的值也不同。
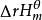 熱化學式
熱化學式(12)的意義是在標準狀態下,下標r表示反應(reaction),m反應進度為ε=1mol,上標Θ表示標準狀態
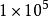 熱化學式
熱化學式 熱化學式
熱化學式(13),在SI單位制中,標準壓力應為101.3kPa,但是這個數字使用不太方便,國際純粹與套用化學聯合會(IUPAC)建議以Pa作為氣態物質的熱力學標誌狀態,符號為pΘ,若壓力不為pΘ,反應焓變符號為。
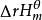 熱化學式
熱化學式 熱化學式
熱化學式(14)中學化學課本將和簡寫成△H,但實際上這二者是有所區別的。△H代表的是一個過程的焓變,兩種符號的意義不同,單位為kJ或J。
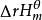 熱化學式
熱化學式 熱化學式
熱化學式對於,和的數值和方程的計量有關,但某一具體的過程的焓變△H的數值與計量方程無關,這一點需要和中學化學區分開來。
套用
1840年俄國的化學家赫斯(Hess)在總結大量實驗事實(熱化學實驗數據)的基礎上提出:“定壓或定容條件下的任意化學反應,在不做其它功時,不論是一步完成的還是幾步完成的,其熱效應總是相同的(反應熱的總值相等)。赫斯定律的建立,使得熱化學方程式可以向普通代數方程式一樣進行計算,有很大的實用性。可以從已知的反應熱數據,經過加減運算得到難以通過實驗測定的反應熱數據。使用時應注意聚集狀態和反應條件是否不同。

