物化性質
 氫氧化亞鐵
氫氧化亞鐵純氫氧化亞鐵(Fe(OH))是白色物質,亞鐵離子(Fe)所形成的沉澱為白色,鐵離子所形成的溶液顯通常為黃褐色,Fe在強酸性水溶液中為淺紫色,Fe在強酸性水溶液中為橘紅色,氫氧化鐵(Fe(OH))是紅褐色。
氧化亞鐵屬於六方晶系,晶格常數a=0.3258nm,c=0.4605nm。在空氣中易被氧化變為紅棕色。在稀酸中迅速溶解生成亞鐵鹽。在鹼性溶液中是強還原劑。氫氧化亞鐵細粉噴射於空氣中,則立即燃燒發出火花。相對密度3.4。受熱時分解。不溶於鹼溶液,難溶於水,溶於氯化銨。
因為溶液中溶解有氧氣且反應體系(開放性的體系)與外界存在著物質交換與能量交換,不斷有空氣中的氧氣溶解到溶液中,新生成的氫氧化亞鐵很快就被氧化成氫氧化鐵,所以在實驗過程中很難觀察到有白色的氫氧化亞鐵沉澱生成,只能看到氫氧化亞鐵轉化為氫氧化鐵的中間產物:一些灰綠色的絮狀沉澱。然後轉化為紅色的氫氧化鐵沉澱。
4Fe(OH)+O+ 2HO= 4Fe(OH)
4Fe(OH)+O =△= 2FeO+4HO
不易製得純物,因Fe(OH)在空氣中迅速被氧化,變成灰綠色*最後變成棕紅色的氫氧化鐵。如將氫氧化亞鐵在非氧化性氣體氣氛中(如N,H等氣體保護)過濾出來,再迅速噴射到空氣中,會劇烈燃燒甚至爆炸。
大部分難溶性鹼不溶於鹼性溶液,但新制的Fe(OH)例外(生成六羥基合亞鐵離子)。久置的氫氧化亞鐵不與鹼反應,因此在鹼性環境下可以保持Fe(OH)性狀,不會變為Fe(OH)。
且可以和硝酸反應:3Fe(OH)+10HNO== 3Fe(NO)+8HO+NO↑
製備方法
工業製法
氫氧化亞鐵的製造通常是向亞鐵鹽溶液中添加鹼金屬氫氧化物,由於容易被氧化,所以必須在惰性氣氛(例如氮氣、氬氣)中進行。純Fe(OH)雖是白色的,但被氧化時則從綠色變為深綠色。
製法1:用煮沸充分去掉溶解於其中的空氣後的水,來配製硫酸亞鐵和氫氧化鈉的稀水溶液。將硫酸亞鐵溶液裝入小口瓶里,向其中注加氫氧化鈉水溶液,使正好成為滿滿一瓶。液量不足時,可以添加除掉空氣的水,然後密封暫時放置。
當氫氧化亞鐵在瓶底部沉澱出來之後,用虹吸管慢慢地將上層澄清液抽出,然後沿著瓶壁慢慢地注加煮沸過的水。要反覆進行這個操作,直至洗淨SO離子為止。如果洗滌時間過長,沉澱就有水解的危險,因此操作要快。可以將製得的含有白色沉澱的溶液上層澄清液捨棄,在氬氣或氮氣流中過濾,然後乾燥。迅速裝入帶塞的玻璃瓶中,密封儲存。
製法2:選用純硫酸亞鐵FeSO·7HO結晶(儘可能選擇顆粒大的、透明的),在預先通氮氣的條件下用煮沸冷卻過的不含氧氣的水溶解,以大約1.6mol/L的濃度為宜。準備約10L濃氫氧化鈉水溶液。這種溶液用不含氧的水配製。在攪拌下,向硫酸亞鐵溶液滴加氫氧化鈉溶液,沉澱沉降之後,用虹吸管將上層澄清液吸出,用無氧水反覆洗滌。過濾後在室溫下乾燥。整個操作過程都要在純氮氣中進行。只要與空氣接觸,接觸處就變色。
實驗室製法
原理
① 製取硫酸亞鐵
用硫酸銅溶液和鐵反應,生成硫酸亞鐵和銅,反應方程式如下:
CuSO+Fe==FeSO+Cu (反應類型屬於置換反應)
② 製取氫氧化亞鐵
用製得的硫酸亞鐵溶液和氫氧化鈉反應生成氫氧化亞鐵沉澱和硫酸鈉,過濾便得氫氧化亞鐵,反應方程式如下:
FeSO+2NaOH==Fe(OH)↓+NaSO (反應類型屬於複分解反應)
方法
在試管里注入少量新製備的硫酸亞鐵溶液,再向其中滴入幾滴煤油,用膠頭滴管吸取氫氧化鈉溶液,將滴管尖端插入試管里溶液液面下,逐滴滴入氫氧化鈉溶液,觀察現象。 另外,為使氫氧化亞鐵的製備成功,先將硫酸亞鐵溶液加熱,除去溶解的氧氣。
現象
滴入溶液到硫酸亞鐵溶液中有白色絮狀沉澱生成。白色沉澱放置一段時間,振盪後迅速變成灰綠色,最後變成紅褐色。
白色沉澱: Fe(OH);灰綠色沉澱: Fe(OH)和Fe(OH)的混合物;紅褐色沉澱:Fe(OH)
改進
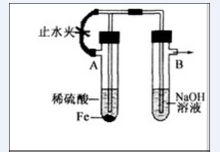 裝置
裝置已知Fe(OH)是白色絮狀沉澱,並極易被空氣中的氧氣氧化成Fe(OH)紅褐色沉澱。右圖為Fe(OH)製備實驗的改進裝置,使用該裝置能在較長時間內觀察到生成的Fe(OH)白色絮狀沉澱。
①A試管中反應開始時,打開止水夾,B試管中看到的現象是
導管口有氣泡產生
②為防止氧化和得到氫氧化亞鐵白色絮狀沉澱下一步
夾緊止水夾
③生成氫氧化亞鐵的化學方程式Fe+HSO=FeSO+H↑
FeSO+2NaOH=Fe(OH)↓+NaSO
套用領域
氫氧化亞鐵不穩定,工業上和生活上通常都是把它轉化為氫氧化鐵,再進行利用。其用途有三種:
1、氫氧化鐵膠體可以用來淨水;
2、制氫氧化鐵;
3、還原水和硝酸;
4、用於制顏料、藥物、並用催化劑、吸收劑和砷解毒劑等。
注意事項
實驗室製取氫氧化亞鐵要注意先把蒸餾水煮沸,除去水中的氧氣,再配製硫酸亞鐵溶液。
再在溶液上加苯,與空氣隔絕。用吸管吸取氫氧化鈉溶液,伸進溶液里擠出,即可製得氫氧化亞鐵。製得的氫氧化亞鐵,要特別注意不能和空氣接觸。

