計算公式
氧化還原反應是一種電子得失(或轉移)反應,其氧化還原當量可由下式求得:氧化還原當量=分子量÷總電子得失(或轉移)數。
在無機物的氧化還原反應中,通常以得失電子書除以其分子量即得其當量;在有機物的氧化還原反應中,以氧化數的變化數除以其分子量,來確定被測物的當量。
相關概念
廣義氧化還原反應及相關定義
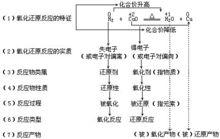 氧化還原反應中相關定義
氧化還原反應中相關定義在無機物之間的反應中,是以得失電子數來判斷是否發生了氧化還原反應,即在化學反應中,元素或化合物失去電子,化合價升高稱之為 被氧化,該元素或化合物為 還原劑;反之,若得到電子,化合價下降為 被還原,稱之為 氧化劑。
在有機反應中,由於碳均為4價,不能用化合價升高或降低的方法來判斷是否發生了氧化還原反應,而是用電子對的偏移程度,也就是碳原子周圍電子云密度的變化來判斷。即:碳原子周圍電子密度升高(部分地得到電子),稱之為被還原;而碳原子周圍電子密度降低(部分地失去電子),稱之為被氧化。這就是“ 廣義氧化還原反應”。
氧化數
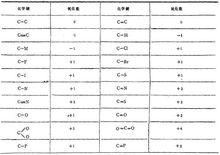 碳原子在不同鍵中的氧化數
碳原子在不同鍵中的氧化數在無機反應中,電子的得失情況可用化合價來表示。
在有機化合物中,電子對的偏移情況可用氧化數來表達。用元素電負性大小來判斷化學鍵極性的方向,也就是電子云的偏移方向。在有機物不同形式的鍵中,碳的氧化數如圖。
凡是電負性比碳大的元素與碳成鍵,對碳來說,氧化數為正值;而電負性比碳小的元素與碳成鍵,氧化數為負值。
差示氧化數法計算有機物氧化還原當量
差示氧化數法的定義
由於在氧化還原反應中,真正起電子得失(或轉移)作用的原子是個別的,其它原子或基團並沒有改變,因而,就可以像分數的約分那樣,將半反應中反應物與生成物結構中相同的原子或基團約去,使複雜的結構變成簡單的幾個原子,然後對比反應前後剩餘部分氧化數的差值。此差值可命名為“差示氧化數”。
利用“差示氧化數”可以根據以下公式計算氧化還原當量:氧化還原當量=分子量÷差示氧化數。
差示氧化數法的計算步驟:
(1)寫出反應前後的主要產物,HO可以不寫;
(2)約去反應前後相同的原子或基團;
(3)根據剩餘部分來比較氧化數的差值。一般約去後,剩下的不外是氧(氧化數為-2)、氫(氧化數為+1)、鹵素(氧化數為-1),即可直接以此值求氧化還原當量或配平反應方程式;
(4)如要知本半反應式是氧化反應還是還原反應,可將左邊值減去右邊值。當結果為“正”,表示為被氧化;結果為“負”,表示為被還原。
差示氧化數法的優點
(1)利用該法確定有機物的當量,只需知道反應前及反應後的氧化數變化值,而與中間產物無關,即不需要配平反應方程式,就可計算出當量,且不管用什麼方法滴定,只要得到同樣的產物,氧化當量是一致的。
(2)反應產物若為多種,只要反應是定量的,可將反應前氧化數與反應後的總氧化數變化相減即可。

