氫化物介紹
 氣態氫化物
氣態氫化物氫與其他元素形成的二元化合物。但一般科學技術工作中總是把氫同金屬的二元化合物稱氫化物,而把氫同非金屬的二元化合物稱某化氫。在周期表中,除稀有氣體外的元素幾乎都可以和氫形成氫化物,大體分為離子型、共價型和過渡型3類,它們的性質各不相同。
離子型
離子型氫化物也稱鹽型氫化物。是氫和鹼金屬、鹼土金屬中的鈣、鍶、鋇、鐳所形成的二元化合物。其固體為離子晶體,如NaH、BaH2等。這些元素的電負性都比氫的電負性小。在這類氫化物中,氫以H-形式存在,熔融態能導電,電解時在陽極放出氫氣。離子型氫化物中氫的氧化數為-1,具有強烈失電子趨勢,是很強的還原劑,在水溶液中與水強烈反應放出氫氣,使溶液呈強鹼性,如:
CaH2+2H2O→Ca(OH)2+2H2↑
在高溫下還原性更強,如:
NaH+2CO→HCOONa+C
2CaH2+PbSO4→PbS+2Ca(OH)2
2LiH+TiO2→Ti+2LiOH
離子型氫化物可由金屬與氫氣在不同條件下直接合成製得。除用做還原劑外,還用做乾燥劑、脫水劑、氫氣發生劑,1kg氫化鋰在標準狀態下同水反應可以產生2.8m3的氫氣。在非水溶劑中與+Ⅲ氧化態的B(Ⅲ),Al(Ⅲ)等生成廣泛用於有機合成和無機合成的複合氫化物,如氫化鋁鋰:
4LiH+AlCl3→LiAlH4+3LiCl
複合氫化物主要用做還原劑、引發劑和催化劑。
共價型
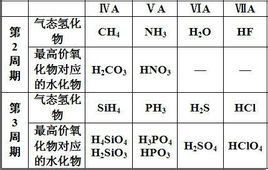
共價型氫化物也稱分子型氫化物。由氫和ⅢA~ⅦA族元素所形成。其中與ⅢA族元素形成的氫化物是缺電子化合物和聚合型氫化物,如乙硼烷B2H6,氫化鋁(AlH3)n等。各共價型氫化物熱穩定性相差十分懸殊,氫化鉛PbH4,氫化鉍BiH3在室溫下強烈分解,氟化氫,水受熱到1000℃時也幾乎不分解。共價型氫化物也有還原性,因氫的氧化數為+1,其還原性大小取決於另一元素R-n失電子能力。一般說,同一族從上至下還原性增強,同一周期從左至右還原性減弱,例如:
4NH3+5O2→4NO+6H2O
2PH3+4O2→P2O5+3H2O
2H2S+3O2→2SO2+2H2O
共價型氫化物在水中的行為較為複雜。常見為:
形成強酸的:HCl,HBr,HI;
形成弱酸的:HF,H2S,H2Se,H2Te;
形成鹼的:NH3;
水解放出氫氣的:B2H6,SiH4;
與水不作用的:CH4,PH3,AsH3,GeH4,SnH4,SbH3。
氫化物RHn給出質子的能力一般與R的電負性、半徑有關。同一周期從左至右酸性隨R的電負性增大而增強;同一族,從上至下,酸性增強主要由R的半徑相應增大決定。酸鹼性強弱由氫化物在水中電離出H+質子的熱化學循環過程中總能量效應決定。
過渡型
過渡型氫化物也稱金屬型氫化物。是除上述兩類外,其餘元素與氫形成的二元化合物,這類氫化物組成不符合正常化合價規律,如,氫化鑭LaH2.76,氫化鈰CeH2.69,氫化鈀Pd2H等。它們晶格中金屬原子的排列基本上保持不變,只是相鄰原子間距離稍有增加。因氫原子占據金屬晶格中的空隙位置,也稱間充型氫化物。過渡型氫化物的形成與金屬本性、溫度以及氫氣分壓有關。它們的性質與母體金屬性質非常相似,並具有明顯的強還原性。一般熱穩定性差,受熱後易放出氫氣。氫氣作為未來很有希望的能源,要解決的中心問題是如何儲存。一些金屬或合金是儲氫的好材料。鈀、鈀合金及鈾都是強吸氫材料,但價格昂貴。近年來,最受人們注意的是鑭鎳-5LaNi5(吸氫後為LaNi5H6),它是一種儲氫的好材料。容量為7L的小鋼瓶內裝鑭鎳-5所能盛的氫氣(304kPa),相當於容量為40L的15000kPa高壓氫氣鋼瓶所容納的氫氣(重量相當),只要略微加熱,LaNi5H6即可把儲存的全部氫氣釋放出來。除鑭鎳-5外,La-Ni-Cu,Zr-Al-Ni,Ti-Fe等吸氫材料也正在研究中。研究中國的豐產元素,尤其是稀土金屬及其合金的吸氫作用有著更重要的意義。
既鹼金屬的氫化物。當鹼金屬跟氫氣發生反應時,就生成鹼金屬的氫化物,它們都是離子化合物,其中氫以陰離子H-的形式存在,如氫化鈉(NaH),氫化鉀(KH)等。
氫跟其他元素生成的二元化合物叫做氫化物。氫化物按它的結構大致分成三類:(1)離子型氫化物(又叫鹽型氫化物)鹼金屬和鹼土金屬中的鈣、鍶、鋇能跟氫氣在高溫下反應,生成離子型氫化物,如NaH、CaH2等,其中氫以H-離子形式存在。這類氫化物都是離子晶體,熔點較高,在熔融狀態下能導電。它們都有強還原性,遇水分解,生成金屬氫氧化物,並放出氫氣。(2)共價型氫化物(又叫分子型氫化物)氯化氫、氨、硫化氫、甲烷等在常溫下呈氣態或液態,水在常溫下呈液態。這類氫化物性質差異較大,如HX、H2S溶於水時電離而顯酸性,NH3溶於水顯鹼性,CH4跟水不發生任何作用,SiH4發生反應:SiH4+4H2O==H4SiO4+4H2↑。(3)金屬型氫化物 鈹、鎂、銦、鈦和d區、f區金屬元素的單質都能跟氫生成金屬氫化物,如BeH2、MgH2、FeH2、CuH等,還有非整數比化合物,如VH0.56、ZrH1.92、PdH0.8等。金屬型氫化物保留金屬的外觀特徵,有金屬光澤,密度比相應金屬小。據最新研究,金屬型氫化物在有機合成及作儲氫材料方面有重要用途。例如,1體積鈀可吸收700~900體積的氫氣成為金屬氫化物,加熱後又釋放出氫氣。