概述
 標準電極電位
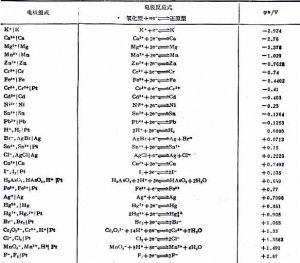
標準電極電位如氫的標準電極電位H2←→H+ 為0.000V,鋅標準電極電位Zn ←→Zn2+ 為-0.762V,銅的標準電極電位Cu ←→Cu2+為+0.337V。
金屬浸在只含有該金屬鹽的電解溶液中,達到平衡時所具有的電極電位,叫做該金屬的平衡電極電位。當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位,叫做標準電極電位。
電極電位
 標準電極電位
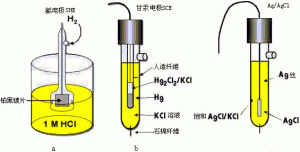
標準電極電位因為電池電動勢容易精確測定,標準氫電極[H+活度為1mol/L、H2分壓為101325.0Pa(1氣壓)、任何溫度]被採用為確定其他電極電位時的標準電極。可見,現用電極電位的數值都是相對值,實際上是這些電極與標準氫電極組成源電池時的電動勢。如果在組成原電池時把標準電極作電池負極(發生氧化反應),所觀察電極作正極(發生還原反應),這樣測得的電池電動勢稱為所觀察電極的還原電極電位(簡稱還原電位);反之為氧化電極電位(簡稱氧化電位)。
電池中的同一電極,還原電位和氧化電位大小相等,符號相反。有時統稱氧化還原電位,採用還原電位者居多。稱在標準狀態下[離子活度為1mol/L或氣體分壓為101325.0Pa(1氣壓)、溫度一般為298K]確定的電極電位為標準電極電位。標準電極電位是電極物質的一項特性常數,僅決定於電極的本性。對於給定的電極,其電位主要與其離子的活度和溶液的溫度有關。金屬電diarl電極和氫電極的電位,隨離子活度的增大而增大,隨溫度的升高而減小;非金屬電極的電位,隨離子活度的增大而減小,隨溫度的升高而增大。但電極電位隨離子活度和溫度而改變的變化不大,因而標準電極電位才是最重要的。
電極反應
 標準電極電位
標準電極電位(2)標準電極電位的正、負數值,不因電極反應進行的方向而改變。例如,不管電極反應是按Zn+2e=Zn,還是按Zn=Zn+2e的方式進行,電對(Zn^+2/Zn或Zn/Zn^+2)的標準電極電位總是負號,
(3)物質的還原態的還原能力自下而上依次增強;物質的氧化態的氧化能力自上而下依次增強。具體地說,電對的電極電位數值越小,在表中的位置越高,物質的還原態的還原能力越強,電對的電極電位數值越大,位置越低,物質的氧化態的氧化能力越強。例如電對Zn^+2/Zn的標準電極電位的數值為-0.76伏較Cu數值+0.34伏為小,所以Zn原子較Cu原子容易失去電子,即Zn是較強的還原劑。
(4)物質的還原態的還原能力越強,其對應的氧化態的氧化能力就越弱;物質氧化態的氧化能力越強,其對應的還原態的還原能力就越弱。最強的還原劑,其對應的K則是最弱的氧化劑,F2是最強的氧化劑,其對應的F則是最弱的還原劑。
(5)只有電極電位數值較小的物質的還原態與電極電位數值較大的物質的氧化態之間才能發生氧化還原反應,兩者電極電位的差別越大,反應就進行得越完全。