普遍化壓縮因子圖
正文
根據實驗數據繪製的表示壓縮因子Z與對比壓力 pr對比溫度Tr關係的曲線圖。壓縮因子是表示實際氣體的p-V-T關係偏離理想氣體狀態方程程度的參數,其定義為:
根據對應態原理,不同氣體處於相同的對比壓力和對比溫度時,具有相同的壓縮因子。因此,壓縮因子可表述為對比壓力pr和對比溫度Tr的函式,即:Z=Z(pr,Tr)。這種關係用圖線表達,即為普遍化壓縮因子圖,通常是以pr為橫坐標,Z為縱坐標,繪出一簇等Tr線(見圖)。
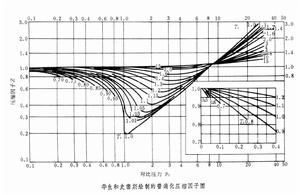 最早的普遍化壓縮因子圖是J.Q.柯普等(1931)和G.G.布朗等(1932)利用烴類實驗數據繪製的。稍後,B.F.道奇用烴類和其他物質的數據繪製這種圖。附圖是K.M.華生和R.L.史密斯利用二氧化碳、氮、氨、甲烷、丙烷和戊烯的實驗數據於1936年所作。L.C.納爾遜和E.F.奧伯特在1954年繪製了更詳細的壓縮因子圖,提高了關聯精度。
最早的普遍化壓縮因子圖是J.Q.柯普等(1931)和G.G.布朗等(1932)利用烴類實驗數據繪製的。稍後,B.F.道奇用烴類和其他物質的數據繪製這種圖。附圖是K.M.華生和R.L.史密斯利用二氧化碳、氮、氨、甲烷、丙烷和戊烯的實驗數據於1936年所作。L.C.納爾遜和E.F.奧伯特在1954年繪製了更詳細的壓縮因子圖,提高了關聯精度。 將壓縮因子僅作為對比溫度、對比壓力的函式,誤差較大。如果引入第三參數,可提高計算的準確度。比較成功的方法是以偏心因子 ω(見對應態原理)為第三參數,這樣,壓縮因子的表達式為:Z=Z【0】+ωZ【1】 。式中Z【0】為具有球形小分子的簡單流體(ω=0)的壓縮因子,Z【1】為偏離簡單流體的校正。Z【0】和Z【1】都是pr和Tr的函式,並已作為圖和表,可供查用。
利用普遍化壓縮因子圖,只要知道物質的臨界壓力、臨界溫度等特性參數,就可計算p-V-T關係。在化學工程中常用於要求不高的工程估算,或對缺乏實驗數據的物質用來近似地表示p-V-T關係。但由於對應態原理是近似性的,如要取得精確計算結果,仍須套用p、V、T實驗數據和狀態方程。普遍化壓縮因子圖亦可用於混合物(見對應態原理)。