普粒子疾病的產生
十八世紀的英國為了改良牛羊的品質,讓它們與自己的後代交配繁殖,此種近親繁殖 可產生肉質鮮美、體格強壯、長的又快的牛羊,但卻萬萬料想不到,其中黑臉無角羊會不 斷的用一種怪姿勢快步行走,並且經常會絆倒,此外不停的抓癢,並顯現出孤僻而焦慮, 最終將很快過世,此種針對羊與山羌,且完全無法治癒的疾病稱為羊搔症(scrapie),剛開 始僅黑臉無角羊感染,繼而十傳百,疾速傳播,進而感染其他種類的羊群,甚至感染接觸 的牛群[1,2],探究其因,源1970-1980間,英國家畜食品製造業因牛羊獸酯價格下滑,為 促進牛肉的成長、提高乳牛乳汁的蛋白含量,開始把由牛的骨髓和內臟磨碎作成新飼料“骨 粉飼料” (bone meal)餵食原本是草食性的牛隻,亦即工廠將老羊作成小羊與小牛的補品, 雖經煮沸仍可感染牛群,當第一隻患有狂牛症的牛回到食物鏈中,成為其他牛的食物,此 鏈鎖反應將迅速被啟動[3]。 旋即於1986年英國首先爆發疾病,畜養的牛隻搖搖晃晃站不穩,不能向前直走,好像 發狂似興奮異常,而且一旦發病必死無疑。往後包括貂、麋鹿等哺乳動物也同時發病,造 成貂之腦性病變TME(transmissible mink encephalophthy)、貓之傳染性腦病變(feline spongiform encephalophthy)、糜鹿之傳染性腦病變CWD(chronic wasting disease),獸醫開始研究羊搔症, 企圖找出臨床疾病及“神經元空泡”的原因,但仍不明其潛伏期為多久。將羊餵食或接種 感染的組織於健康的羊只,而等待其發病,但數月之後,實驗仍宣告失敗,即使費盡心思 也無法追查出真相,後來才知道潛伏期長達1-2年,羊搔症才會傳到健康的羊,直接將感 染物接種到腦或脊髓,則潛伏期可縮短,經由其它周邊路線則較長[1-3]。稍後獸醫學家針 對某些疾病進行疫苗測試時,未料爆發羊搔症大流行,此疫苗的研製源於羊腦,令人百思 不解的是疫苗製造過程中,福馬林、清潔劑、煮沸、紫外線皆無法將之殲滅,此種感染物 質能夠通過可抓住病毒的濾膜,即使動物被感染,不會產生免疫反應,發病需漫長的一段 時間,除非直接將致病因子直接導入腦內,才會疾速發病。如果把牛隻的腦放在顯微鏡仔 細觀察,結果發現腦內的細胞朝遭到破壞,出現了無數的空洞,看來就像是海綿一樣[4]。 羊搔症徹底擊潰了傳統微生物的理念,揭露此謎底的兩位科學家分別榮獲諾貝爾獎。
普粒子疾病之病理生理
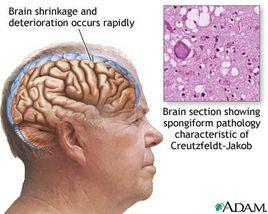
prion病臨床表現很廣泛,包括失憶症、動作失調 (ataxia)、失眠、四肢癱瘓、感覺麻 痹、行為偏差、判斷力不足、情緒不穩定 (如憂鬱、焦躁、妄想等)、走路不穩、智力減退 及進行性運動功能障礙、50%病患視野減小。特徵為大腦切片在顯微鏡下顯示神經細胞大 量死亡,而存活的神經細胞之間有許多的空隙存在,因沒染上色,看來如同海綿的空洞一 般即所謂的spongiform encephalophathies,有些報告指出病患的闌尾與扁桃腺組織可分離 出PrPsc。神經病理髮現由廣泛萎縮到毫無萎縮,由很少到很多的神經元損失,由至微至至 大空泡或海綿樣的變化,從輕到重反應性的星狀細胞纖維增多症 (astrocytogliosis),從無到 很豐富的PrP類澱粉般塊的存在。這些發現物當中,只有PrP類澱粉斑可作為唯一的診斷 [6-9]。
CJD散髮型 (sporadic type)的表現為失眠症、肌肉痙攣,占人類 所有prion病的85%,它通常連續的病情進展,一年內趨向死亡。除新變體型的CJD外, 研究皆顯示與PRNP基因突變有關。散髮型的prion病可以因自體突變所起發,發展的狀態 與生殖系突變造成的prion病相似,突變的PrPsc必須能配備有天然的PrPc。其他15%各為感 染及遺傳型的prion病例,遺傳prion病它是屬第20對體染色體上的PrNP gene之變異且為 顯性遺傳,在人類PRNP基因,可找到20個突變型包括遺失型突變 (missense mutation)及 基因peptide重複區的擴展皆可造成家族性prion病[7],1970年代科學家發現14個案例皆 嗜吃羊腦,認為飲食習慣為重要因子,但後來又發現14個案例皆從利比亞猶太人移民至以 色列,此種族發生率預估盛行率為一般種族的100倍,因此不排除種族因素[3]。CJD病患 腦子外觀並無異常發現,能存活數年病例的腦子可見到各種程度的大腦萎縮。顯微結構為 海綿狀退化及星狀纖維增生(astrogliosis)[7]。
流行病調查
在人類CJD的感染則大部分屬於醫源性感染,例如在神經外科中使用的器械若是受污 染(含PrPsc),或是中樞神經系統組織及其粹取物之傳遞均已證實可造成CJD污染, 至於其 它如眼角膜移植,同樣會造成人傳人的CJD之病例。此外1987年CJD首次證實可由接受 硬腦膜(dura mater)移植而感染罹病。隨後在1989年,紐西蘭一位25歲的青年也是 在相同 的情況下遭受感染。因為這二例均由同一公司提供硬腦膜組織,因此硬腦膜被推斷 與造成 醫源感染性CJD有關。目前在15篇病例報告中,有20位罹病者與硬腦膜之移植有關 ,最 近有一份研究報告指出至少有25件類似病例存在,且其範圍涵蓋澳大利亞、加拿大、德 國、義大利、日本、紐西蘭、西班牙、英國及美國等地。日本最近報告有超過40例的CJD系因 接受硬腦膜移植而引發。這些案例中,大多數都是使用同一家廠商提供之硬腦膜, 其製造之 過程顯然不適當,因而無法使prion因子失去活性,再加上這些硬腦膜均混在一起 處理因而 造成如此多的病例[5,10]。
1977年曾發生兩位癲癇病患感染庫賈氏症,主因使用的腦部手術探勘電極曾經被CJD病 患使用過,若將電極用在黑猩猩身上,它們很快的染上CJD。過去治療一個生長荷 爾蒙 不足的身材矮小病患,須從上千個屍體的腦下垂體中提煉出生長荷爾蒙,因而 造成 至少上 百人感染CJD。雖然CJD之平均潛伏期相當長(約由18個月至13年之間),但在某些感染 個案中發現使用遭污染的神經外科手術器具數星期後即可罹病。加上先前已討論過PrPsc無 法用任何物理化學的方法消毒去活性,所以使用拋棄式的器械,變成是腦神經手術 避免 感染醫源性prion disease的唯一方法,目前僅推論PrPc僅存於淋巴球與單核球上 ,但含量 最高的地方還是存在於腦部組織,所以這可能也是輸血的感染力較腦部移植等手術 低的原 因[5,10]。
依據流行病學統計顯示,全世界每年每百萬人口約有0.05-1.5的 CJD病例。1979年 之後,此一比率為0.3-1.5病例/百萬人口/年。年齡層分布比例則仍為一致 ,30歲以下 之病例非常罕見,50歲以下之病例僅占少數,而占最高比例的罹病年齡層介於60~70歲 之間,60-75歲的發生率為每百萬五例。如果CJD可經由血液傳染,則主要之病例應集中 在年輕人階層,尤其是在潛伏期較短的情形尤應如此。即使疾病潛伏期超過10年以上,仍 可能因為在嬰兒或孩童期接受輸血而使發病年齡仍然集中在年青時期,然而CJD在年輕人 身上發病的比例仍非常低,此一情形也可能是因醫師對年輕人族群較傾向於診斷為神經系 統疾病而非CJD之故。Chipps E等人調查發現此疾病無論性別、社經地位與職業其盛行率 皆無差異,例如以醫護人員而言,1994年全世界有9位護理人員、3位牙醫師、3位護佐、 2位病理醫檢師等感染CJD,此數目存屬機率之故[11]。
牛被感染後平均需五年才發病,人則為十年,因此當1986年底發現六宗牛被感染案件 時,其實已經有五萬頭被感染,被感染後無任何生物可以倖免於死。由於狂牛病和 羊瘙癢 病的症狀以及病變有許多相類似之處,英國政府表示“骨粉中使用了含羊瘙癢病的 羊,牛吃了這種受到污染的骨粉極有可能會有狂牛病”,英國於 1988 年宣布禁止使用骨 粉,美 國則於1997年跟進[9]。但是1992至1993年期間,狂牛病的流行達到顛峰,每 個月約有 3,500頭,全年總計4萬頭牛隻因而死亡,雖有人認為這些牛可能是在禁止使用骨 粉前已 經受到感染,經過四、五年的潛伏期才發病,不過真正的流行原因,卻始終無人知 曉,幸後來發病的數量有明顯減少的傾向,英國民眾也放下了心中的一塊大石頭[5,10]。