發展歷程
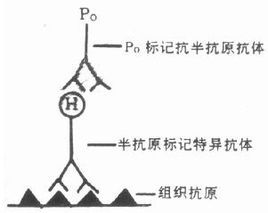
 抗體酶
抗體酶特性
 抗體酶
抗體酶將抗體轉變為酶主要通過誘導法、引入法、拷貝法三種途徑。誘導法是利用反應過渡態類似物為半抗原製作單克隆抗體,篩選出具高催化活性的單抗即抗體酶;引入法則藉助基因工程和蛋白質工程將催化基因引入到特異抗體的抗原結合位點上,使其獲得催化功能,拷貝法主要根據抗體生成過程中抗原-抗體互補性來設計的。博萊克(Pollack)等以硝基苯酚磷酸膽鹼酯作為半抗原誘導產生單抗,經篩選找到加快水解反應1.2萬倍的抗體酶。
主要功能
抗體酶可催化多種化學反應,包括酯水解、醯胺水解、醯基轉移、光誘導反應、氧化還原分應、金屬螯合反應等。其中有的反應過去根本不存在一種生物催化劑能催化它們進行,甚至可以使熱力學上無法進行的反應得以進行。
抗體酶的研究,為人們提供了一條合理途徑去設計適合於市場需要的蛋白質,即人為地設計製作酶。它是酶工程的一個全新領域。利用動物免疫系統產生抗體的高度專一性,可以得到一系列高度專一性的抗體酶,使抗體酶不斷豐富。隨之出現大量針對性強、藥效高的藥物。立本專一性抗體酶的研究,使生產高純度立體專一性的藥物成為現實。以某個生化反應的過渡態類似物來誘導免疫反應,產生特定抗體酶,以治療某種酶先天性缺陷的遺傳病。抗體酶可有選擇地使病毒外殼蛋白的肽鍵裂解,從而防止病毒與靶細胞結合。抗體酶的固定化已獲得成功,將大大地推進工業化進程。