概述
 速度逐漸提高,樣品按大小先後沉澱
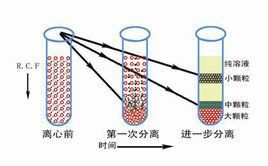
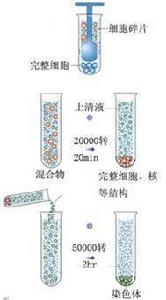
速度逐漸提高,樣品按大小先後沉澱差速離心是指低速與高速離心交替進行,使各種沉降係數不同的顆粒先後沉澱下來,達到分離的目的。沉降係數差別在一個或幾個數量級的顆粒,可以用此法分離。樣品離心時,在同一離心條件下,沉降速度不同,通過不斷增加相對離心力,使一個非均勻混合液內的大小、形狀不同的粒子分部沉澱。操作過程中一般是在離心後用傾倒的辦法把上清液與沉澱分開,然後將上清液加高轉速離心,分離出第二部分沉澱,如此往復加高轉速,逐級分離出所需要的物質。差速離心方法較簡單,但解析度不高,沉澱係數在同一個數量級內的各種粒子不容易分開,常用於其他分離手段之前的粗製品提取。
在差速離心中細胞器沉降的順序依次為:核、線粒體、溶酶體與過氧化物酶體、內質網與高基體、最後為核蛋白體。由於各種細胞器在大小和密度上相互重疊,而且某些慢沉降顆粒常常被快沉降顆粒裹到沉澱塊中,一般重複2~3次效果會好一些。差速離心只用於分離大小懸殊的細胞,更多用於分離細胞器。通過差速離心可將細胞器初步分離,常需進一步通過密度梯離心再行分離純化。
基本原理
 差速離心
差速離心物體圍繞中心軸鏇轉時會受到離心力F的作用。當物體的質量為 M、體積為V、密度為D、鏇轉半徑為r、角速度為(弧度數/秒)時,可得: F=Mω2r 或者 F=V.D.ω2r (1) 上述表明:被離心物質所受到的離心力與該物質的質量、體積、密度、離心角速度以及鏇轉半徑呈正比關係。離心力越大,被離心物質沉降得越快。 在離心過程中,被離心物質還要克服浮力和摩擦力的阻礙作用。浮力F}和摩擦力F}}分別由下式表示: F’=V.D’.ω2r (2) F’’=f dr/dt (3) 其中D}為溶液密度,f為摩擦係數,dr/dt為沉降速度(單位時間內鏇轉半徑的改變)。 在一定條件下,可有 :F=F’+F’’ V.D. ω2r =V.D’ω2r + f. dr/dt dr/dt =Vω2r (D-D’)/f (4) 式(4)表明,沉降速度與被離心物質的體積、密度差呈正比,與f成反比。若以S表示單位力場(ω2r=1)下的沉降速度,則 S=V (D-D’)/f S即為沉降係數。 沉降係數對於生物大分子來說,多數在(1~500)×10-13秒之間。為套用方便起見,人們規定1×10-13秒為一個單位(或稱1S)。一般單純的蛋白質在1~20S之間,較大核酸分 子在4~100S之間,更大的亞細胞結構在30~500S之間。
以蛋白質為例
 差速離心
差速離心溶液中的蛋白質在受到強大的離心作用時,如果蛋白質溶液的密度大於溶劑的密度,蛋白質分子就會下沉,在離心場中,蛋白質分子所受到的淨離心力(離心力減去浮力)與溶劑的摩擦力平衡時,每單位離心場強度定值,這個定值即為沉降係數(sedimentation coefficient)。沉降速度用每單位時間內顆粒下沉的距離來表示。
測定方法
⑴樣品:蛋白質
⑵樣品溶液與離心:將樣品溶於緩衝液中,用一定規格的雙槽分析池,一邊加入溶液一邊加入溶劑。分析池與平衡池平衡重量,使平衡池比分析池輕0.5g以內,然後分別裝入分析轉頭。抽真空。開Schlieren光光源,選擇工作速度,室溫離心。轉動腔達到真空後離以機開始運轉加速,此時在觀察視窗可以看到離心圖型。達到工作速度後恆速離心。
優點
差速離心法的優點是樣品的處理量較大,可用於大量樣品的初分離。其缺點是分離複雜樣品和要求分離純度較高時,離心次數多,操作繁雜。由於沉澱的多次清洗、溶解、再沉澱,容易引起中間損失,所以離心分辨力差。實際分離時由於離心時的對流、擴散和收取沉澱時的污染,對於一些沉降係數相差不大的組分無法進行完全的分離提純。產品的純度和回收率都達不到上述理論值。因此差速離心法主要用於大量樣品的初步分離提純。