概述
又稱轉運肽(transit peptide)或導向序列(targeting sequence),它是游離核糖體上合成的蛋白質的N-端信號。導肽是新生蛋白N-端一段大約20~80個胺基酸的肽鏈, 通常帶正電荷的鹼性胺基酸(特別是精氨酸和賴氨酸)含量較為豐富,如果它們被不帶電荷的胺基酸取代就不起引導作用,說明這些胺基酸對於蛋白質的定位具有重要作用。這些胺基酸分散於不帶電荷的胺基酸序列之間。轉運肽序列中不含有或基本不含有帶負電荷的酸性胺基酸,並且有形成兩性α螺鏇的傾向。轉運肽的這種特徵性的結構有利於穿過線粒體的雙層膜。不同的轉運肽之間沒有同源性,說明導肽的序列與識別的特異性有關,而與二級或高級結構無太大關係。
導肽運送蛋白質時具有以下特點:
①需要受體; ②消耗ATP; ③需要分子伴侶; ④要電化學梯度驅動; ⑤要信號肽酶切除信號肽;⑥通過接觸點進入;⑦非摺疊形式運輸。
導肽的結構和功能
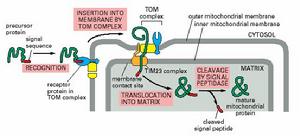
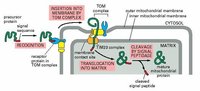 導肽介導的蛋白轉運
導肽介導的蛋白轉運翻譯後膜的插入依賴於前導順序。線粒體和葉綠體都能合成其本身的核酸和某些蛋白。線粒體只合成約10種細胞器蛋白,葉綠體合成20%的細胞器蛋白,細胞器蛋白是在細胞液中合成的,和通過游離的核糖合成胞液的蛋白方式相同,合成後再轉運到細胞器中。
進入線粒體或葉綠體的蛋白是要通過翻譯後加工,初始合成的前體要比成熟的蛋白長12-20aa,前導肽負責細胞器外膜的初始識別,導肽起始了前體蛋白和細胞器膜的相互作用。導肽穿越過膜後被細胞器的蛋白酶切下轉運繼續進行整個的蛋白都穿越過膜,或直到中部的順序導致轉運的停止。
輸入到線粒體或葉綠體的蛋白的導肽有很少的同源性。
導肽通常是疏水的。由非電負性胺基酸構成,中間夾有鹼性胺基酸,而沒有酸性胺基酸,羥基胺基酸含量高(特別是Ser),易形成雙親a螺鏇輪。不同的前導順序缺乏同源性,這意味著和識別有關的信號不是一極結構,而是二極三極結構,或這一區域產生的特點。有一種可能是此前導肽形成一種雙親螺鏇(amphiphilichelix),即帶電荷的基團在螺鏇的一側,不帶電荷的在另一側。
前導肽含有作為細胞器蛋白定位所需的所有信息。導肽的這種能力可以通過構建入工蛋白來檢驗。將來自細胞器的導肽和位於胞液中的蛋白連線起來。具體方法是構建融合基因(fusiongere)然後翻譯成融合蛋白。
各種導肽通過這種實驗表現出具有獨立引導附著順序進入線粒體或葉綠體靶位點的功能。導肽加到小鼠胞液蛋白二氫葉酸還原酶(DHFR,dihydrofllatereductase)上,此DHFR就可變成定位於線粒體的蛋白。
導肽和轉運蛋白存在著獨立摺疊的結構域。如不改變附加上的順序,導肽必須能摺疊成一個適當的結構供細胞器表面受體識別。附加順序對識別不起作用。
 MPP水解切除導肽的肽酶
MPP水解切除導肽的肽酶越膜運輸需要ATP的水解,蛋白磷酸化和轉運直接相關,它需要ATP為轉運裝置的成份提供能量,或者為轉運時多肽的去摺疊所需。看來越膜轉運,導肽與膜的結合早期階段並不需要ATP水解,而是進入膜以後或轉運的本身需要ATP。
是什麼為越膜提供了力量呢?進入線粒體(及細菌的輸出)需要一種電化學的電勢(electrochemicalpotential)使導肽的N-端穿過內膜(innermembrane)進行轉運。蛋白質其餘部分的轉運並不需膜電位,這就意味著導肽結構就足以越過脂雙層所構成的障礙。
是什麼限制了轉運的親水蛋白通過疏水性的膜呢?氨甲喋呤(Methotrexate)的發現解決了這一問題。它可作DHFR的標識,並阻礙線粒體導肽融合的DHFR轉運到線粒體中與靶結合,氨甲喋呤在DHFR越膜時阻礙了此酶形成非摺疊。因此雖轉運蛋白的順序不適合於靶目標,但為了使它的導肽穿過膜就需要隨之而形成非摺疊的構象。
穿越線粒體膜需要一系列的摺疊和非摺疊。當完成合成後,新合成的蛋白被釋放到胞液中後就形成了摺疊。而穿越線粒體膜時又需要非摺疊的構象。蛋白越膜以後以非摺疊的狀態存在,但需進一步摺疊成成熟的構象。最後的摺疊需要一種附屬蛋白-分子伴侶(chaperonin)的存在。
線粒體輸入裝置的很多成分已被鑑別出來,在輸入的第一階段是與外膜(outermembrane)上的受體結合,蛋白再進入輸入孔道。各種受體對於輸入蛋白存著特異性。有的蛋白只有一種受體,有的有多種受體。
當已輸入的蛋白錨定在基質上時,它和基質蛋白hsp(heatshock)70結合,這是一種和其它應激(stress)蛋白hsp70有關的分子伴侶(應激蛋白或熱休克)蛋白都因應激而產生的分子伴侶,其作用是和不適當摺疊的蛋白相結合)。很可能當hsp70從內膜露出時對於蛋白的非摺疊構象的形成是高效的,它可幫著把蛋白拉過孔道。
線上粒體基質中應激蛋白hsp60可激活分子伴侶。Hsp60是以一種大的寡聚體式存在(14個亞基,60KDa)。它和細菌的分子伴侶GroEL同源。當hsp60和輸入蛋白結合時,它維持這些蛋白的鬆散摺疊的形式。通過ATP的裂解它可被釋放出來。此hsp60寡聚體可以提供一個基質蛋白上的支架(將輸入蛋白裝配成成熟型。對於輸入蛋白亞基連線形成寡聚複合體是需要與hsp60結合,一種輸入蛋白在形成適當構象的過程中可以由hsp70傳遞給hsp60。
線粒體蛋白在兩種不同的條件下年摺疊:存在離子和分子伴侶的條件在胞液中和線上粒體基質中是不同的,線上粒體中的摺疊是特異地靠hsp60的幫助。由此可能形成不同的構象。線粒體蛋白只有線上粒中才能獲得成熟的構象。