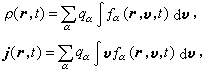簡介
高價金屬元素如鋁(III)、鐵(III)、鉻(III)、釷(IV)、鈾(VI)、鈦(IV)極易形成多鹼。
在皮革鞣製、人工心臟瓣膜研製、催化劑研製中廣泛套用多鹼。
形成
通過羥橋或氧橋形成的以弱鹼性金屬離子為中心的雙核或多核配合物(見配位化合物),例如:
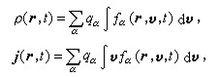 圖1
圖1(圖1)
這是兩個鉻通過一個羥橋相聯形成的雙鹼。此外也有以兩個、三個羥橋相聯形成的雙鹼:
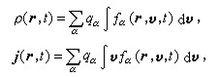 圖2
圖2(圖2)
進一步的羥聯作用,可將更多的金屬離子聯結起來形成多鹼。加熱、增高pH或放置陳化時,羥橋可轉變為氧橋:
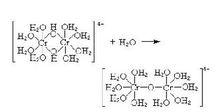 圖3
圖3(圖3)
有些剛剛沉澱的氫氧化物加酸即可溶解,當放置一段時間或加熱後再加酸則不溶,就是因為形成了氧橋化合物。高電荷、小體積的陽離子容易形成多鹼。二價和二價以上的金屬離子,除少數外,都能形成多鹼。
多鹼的形成開始是水合金屬離子的酸電離作用,接著為聚合作用。第一步很快,第二步包括斷裂M-OH2鍵(M為金屬原子),在兩個或兩個以上金屬離子間生成羥橋,要慢得多。隨著溶液pH值的增加和溫度的增高,聚合作用的傾向也增強,最後可形成膠體、晶體高聚羥化物或水合氧化物。金屬離子的濃度也影響聚合作用,濃度愈高,生成的多核羥合物愈多。按照形成多鹼的情況,其聚合度有定數和無定數兩種。前者如Be2+ 離子,可生成Be2(OH)3+和 Be3(OH)5+,Sn2+ 離子可生成Sn2(OH)3+和Sn3(OH)5+等一、二種多鹼;後者如Sc3+、Th4+和Sb5+等高電荷離子,它們可生成二核、三核以及聚合度更高的羥合離子,例如Sc3(OH)8+、Th6(OH)17+和Sb12(OH)59+等。 多鹼的生成是無機化學中一個重要而普遍的現象,在理論上和實用上均有很大的意義。高價金屬元素如鋁、鐵、鉻、釷、鈾、鈦、鋯等極易水解形成多鹼,簡單離子只在高酸度溶液中存在。它們的提取、分離和利用,均與多鹼的性質有關,例如皮革工業中的鉻鞣法,要使鉻(Ⅲ)呈多鹼狀態才能鞣革。