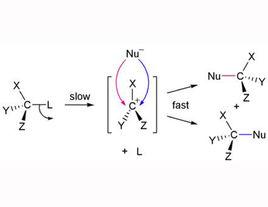
反應機制
S1反應的反應機理可概述為:反應物首先解離為碳正離子與帶負電荷的離去基團,這個過程需要能量,是控制反應速率的一步。分子解離後,碳正離子立即與親核試劑結合,是快的一步。以叔丁基溴在鹼性溶液中的水解反應為例,其反應步驟如下:
反應的第一步是叔丁基溴緩慢解離形成叔丁基正碳離子和溴負離子,這一過程需要的能量大,是控制反應速率的一步,也是慢的一步。
第一步
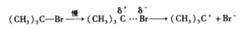 單分子親核取代反應
單分子親核取代反應第一步生成的正碳離子性質活潑,稱為活性中間體。而正碳離子的穩定性是影響S1速率的主要因素,越穩定的正碳離子越容易形成,形成的速度也越快,所以S1反應中,鹵代烷的反應活性與正碳離子的穩定性次序相同。正碳離子一旦形成,立即與親核試劑OH 結合生成產物,並釋放能量,這就是反應的第二步,是快的一步。
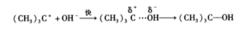 單分子親核取代反應
單分子親核取代反應第二步
第二步反應較慢,是決定整個反應速率的步驟。由於整個反應僅與叔丁基溴的濃度有關,而且發生共價鍵變化的也只有叔丁基溴一種分子,而與親核試劑的濃度無關,所以稱為單分子親核取代反應(S1)。
SN1反應的特點
①S1反應為一級反應。
②反應分步進行,有碳正離子中間體生成,常發生重排。
③反應物中心碳原子是手性碳原子時,產物外消旋化(旋光性部分或全部消失)。
影響因素
鹵代烷結構
在鹵代烷的S1反應機理中,生成活性中間體碳正離子的第一步是決速步驟,由於烷基碳正離子的穩定性次序是(CH)C >(CH)CH >CH3CH >CH ,所以鹵代烷進行S1反應的活性次序為(CH)CX(3°)>(CH)CHX(2°)>CHCHX(1°)>CHX°。
親核試劑
S1反應機理中,鹵代烷解離成碳正離子是控速步驟,親核試劑並不參與,故S1反應速率不受親核試劑的影響。
離去基團
離去基團(X )從碳鹵鍵中解離的活性大小,對S1和S2反應都有影響,解離的活性越大,對反應越有利。由於S2反應中形成過渡態時還有親核試劑Nu 的影響,因此,離去基團對S1反應影響的程度更大一些。
SN1的立體化學觀點
在S1的反應過程中,由於解離形成的碳正離子經SP軌道雜化具有平面構型。因而親核試劑向碳正離子形成的兩個面進攻的機率是相等的,生成的產物一般為外消旋體。這個反應過程稱為外消旋化。然而多數情況下,在外消旋化進的同時,部分產物會發生構型改變,從而具有不同的旋光性。