背景知識
有機反應類型分類
根據共價鍵斷裂的方式,有機化學反應可以分為協同反應,自由基反應,離子型反應。
協同反應:在反應過程中,舊鍵的斷裂和新鍵的形成都相互協調地在同一步驟中完成的反應稱為協同反應。協同反應往往有一個環狀過渡態。它事一種基元反應。
自由基型反應: 由於分子經過均裂產生自由基而引發的反應稱為自由基型反應。自由基型反應分鏈引發、鏈轉移和鏈終止三個階段。
離子型反應:出分子經過異裂生成離子而引發的反應稱為離子型反應 。 離子型反應有親核反應和親電反應。 由親核試劑進攻而發生的反應稱為親核反應,親核試劑是對正原子核有顯著親和力而起反應的試劑。由親電試劑進攻而發生的反應稱為親電反應。而親核以及親電反應又可以進一步分為加成反應和取代反應。
反應物與試劑
反應物和試劑之間沒有十分嚴格的界限,是個相對的概念、 慣用語。本來相互作用的兩種物質,即可互為反應物, 也可互為試劑。但為了討論和研究問題時方便,從經驗中人為的規定反應中的一種有機物為反應物,無機物或另一種有機物為試劑。
單分子親核取代歷程
發生在鹵代烷、醇、磺酸酯等有機化合物的飽和碳原子上的親核取代主要有兩種機理,即單分子親核取代反應(用SN1表示)和雙分子親核取代反應(用SN2表示),其中S代表取代(substitution),N代表親核(nucleophilic),1代表單分子,2代表雙分子。
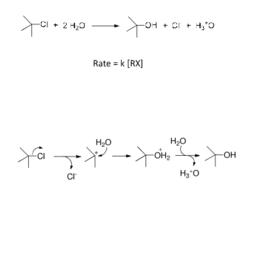
飽和碳原子上單分子親核取代反套用SN1表示,以叔丁基氯的水解為例:
 單分子親核取代
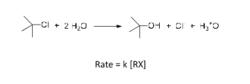
單分子親核取代反應機理如下:
反應分步進行。首先C‐Cl鍵發生異裂生成碳正離子和氯負離子,碳正離子接受溶劑的親核進攻,生成質子化的醇,和水發生質子交換最後得到醇。反應發生在飽和碳原子,即sp3碳原子上,淨結果是氯被羥基所取代,水作為親核試劑進攻到碳原子上,因此,稱為飽和碳原子上的親核取代。反應的決速步驟是C‐Cl鍵的異裂,反應速度只和叔丁基氯的濃度有關,和親核試劑的濃度無關,因此,是單分子反應動力學。總體上講,該反應稱為飽和碳原子上單分子親核取代反應,即SN1反應。
 單分子親核取代
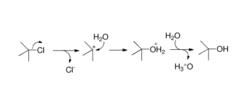
單分子親核取代反應的決速步驟是C‐X鍵的異裂,因此,離去基團對SN1反應速度的影響如下,氟代烴不能作為SN1反應的底物:R-I > R-Br > R-Cl。SN1反應為單分子反應動力學,反應速度只和底物的濃度有關,和親核試劑的濃度無關,因此,親核性的強弱對SN1反應無影響。
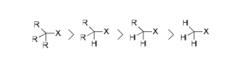
反應涉及碳正離子中間體的生成,生成的碳正離子越穩定,越有利於SN1反應,因此,鹵代烴中烴基對SN1反應速度的影響如下:
 單分子親核取代
單分子親核取代能穩定碳正離子和離去基團的溶劑,如極性質子性溶劑,能加速SN1反應。碳正離子一旦形成就會涉及碳正離子的重排,生成更穩定的碳正離子;加上碳正離子的多途徑反應,如β-消除等,使產物複雜化。
碳正離子是一個平面結構,親核試劑從可以平面的兩側進攻碳正離子,理論上產物是一對對映體,沒有立體選擇性。
多數情況下,SN1反應優先得到構型翻轉的產物。這可從離子對理論進行解釋。離子對理論認為,C-X鍵的異裂經過緊密離子對、溶劑間隔離子對,最後成為自由的碳正離子。只有自由的碳正離子才是以均等的幾率接受親核試劑的兩面進攻。親核試劑進攻底物、緊密離子對、溶劑間隔離子對時,都是從離去基團的反面進行進攻。因此,主要產物為構型翻轉的產物。
與雙分子親核取代差異性比較
與SN1反應相對應,SN2反應中,親核試劑帶著一對孤對電子進攻具親電性的缺電子中心原子,形成過渡態的同時,離去基團離去。反應中不生成碳正離子,速率控制步驟是上述的協同步驟,反應速率與兩種物質的濃度成正比,因此稱為雙分子親核取代反應。無機化學中,常稱雙分子親核取代反應類型的反應機理為“交換機理”。SN2反應一步完成。單分子親核取代反應分兩步進行,雙分子親核取代反應只有一步,他們都有構型翻轉或保持。
SN2屬於二級反應,決速步與兩個反應物的濃度相關:親核試劑和底物。與此相對比的是單分子親核取代反應—SN1反應的速率控制步驟只和底物的濃度有關,稱為單分子親核取代反應。
需要注意的是,SN1和SN2隻是親核取代反應的兩個比較極端的機理,屬於理想情況。在因素如離子對的影響下,實際中的反應都會或多或少地兼具這兩者機理的成分,有些甚至難以歸類。
至於反應按哪種機理進行的成分多一些,與具體的反應物結構、類型、溶劑、濃度、溫度、親核試劑、離去基團等因素都有很密切的關係。