合金結構
正文
兩種或兩種以上金屬元素(或其基本的一種是金屬元素)相互結合而成的穩定的、具有金屬性質的物質稱為合金。能形成合金是金屬的最重要性質之一。不同金屬元素間相互作用的方式有四種:①無論在固態或液態下都不作用;②在液態下相溶、在固態下形成共晶體系或局部互溶的共晶體系;③在固態下形成連續固溶體;④在固態下形成一種或幾種金屬互化物。固溶體 兩種或多種元素相互溶解而形成的均勻晶相(各元素含量變化未破壞晶體的結構)。固溶體有置換式、填隙式和缺位式三種基本類型:
①置換固溶體 單胞中的原子數目保持與純溶劑相同,由一種元素替代另一種元素或替代一個化合物中的某一元素,或一個化合物替代另一個化合物(圖1)。形成置換固溶體的條件是:相互替代的組元應該具有相同的晶胞形狀,原子半徑差不超過15%,電負性和電子結構相近。
 合金結構
合金結構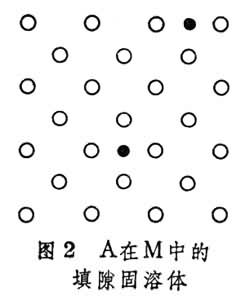 合金結構
合金結構③缺位固溶體 單胞中的原子數目少於純溶劑。在這種固溶體中,作為溶劑的只能是化合物。當元素M溶在MmAn化合物中時,M仍占據MmAn中M應占據的位置,而屬於A元素的部分位置則空著(圖3)。
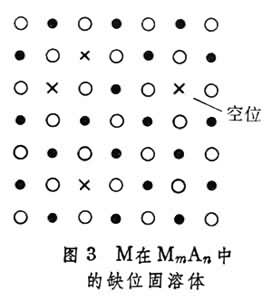 合金結構
合金結構金屬互化物 兩種或兩種以上的金屬元素相互化合形成的結構和性能都不同於原來金屬元素的化合物。
①電子化合物也稱休謨-饒塞里相 其結構主要由電子濃度來決定。電子濃度的定義是每個原子的平均價電子數,對於缺陷結構,則用單胞的價電子數表示。對於面心立方結構 α相,其極限電子濃度為7/5;體心立方β相為3/2;對於複雜立方結構,每單胞含52個原子的γ相為21/13;而對於六方密堆積ε相和ζ相則為7/4。電子化合物的極限化學成分相當於該結構的第一布里淵區被填滿。
②拉夫斯相 其理想化學式為AB2型。這類相的形成主要取決於兩元素的原子半徑比。其理想比值rA/rB為1.225,其實際存在範圍為1.05~1.68,大部分為1.1~1.4。半徑比在這個範圍內的等原子化合物,通常形成氯化銫結構。拉夫斯相有三種不同堆垛,與其密切相關的結構有:空間群為Fd3m,每單胞含化合式單位Z=8(Z為配位數)的MgCu2(C15)型結構;空間群為P6/mmc,Z=4的MgZn2(C14)型結構;空間群為P6/mmc,Z=8的MgNi2(C36)型結構。三種結構類型所占的比例分別為68%、30%和2%,拉夫斯相的結構特點是配位數大和堆積係數高。
③正常價化合物 其特點是符合價鍵規律,這類結構以離子鍵或共價鍵為主,它們通常含有元素周期表的ⅣB、ⅤB或ⅥB的一種類金屬元素,如具有氟化鈣型結構的Mg2Si、Mg2Ge、Mg2Sn、Mg2Pb等,以離子鍵為主。Ⅲ-Ⅴ族化合物具有閃鋅礦型結構,以共價鍵為主。(見金屬晶體)
間隙化合物 由一種金屬元素(如過渡元素)與氫、硼、碳、氮、矽可形成具有金屬性質的化合物。當rx/rm≤0.59時(rx與rm分別為非金屬與金屬原子半徑),則金屬原子組成面心立方或六角密堆積,在個別的情況下組成體心立方或簡單六方,非金屬原子占據屬於某一等效點系的間隙位置,形成簡單化學配比MX2、MX、M2X、M4X型的間隙化合物。由於氫、硼、碳、氮、矽的第一電離勢很小,非金屬原子的部分價電子轉移到過渡金屬的d帶,使間隙化合物具有高熔點和高硬度。
