簡介
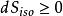 反應最大功
反應最大功熱力學第一定律提供了建立化學反應過程能量平衡方程式的基礎,它使我們有可能建立諸如反應的熱效應等重要關係式。熱力學第二定律所揭示的規律包含在它的數學表達式中,即: 。由熱力學第二定律出發,可以回答在化學過程中遇到的以下問題:
(1)確定化學過程可能進行的方向;
(2)確定反應的最大功;
(3)分析化學平衡,等等。
首先,熱力學第二定律告訴我們,在孤立系統中一切過程只能沿著熵增的方向進行,或者在極限的情況下熵維持不變,而任何使熵減少的過程是不可能發生的。我們說這一結論適用於孤立系內發生的一切自然過程,當然也適用於化學過程。在孤立系內,一切導致熵增加的反應是能夠進行的。如果某化學反應的全部結果是使體系的熵減少,則這樣的過程是不可能發生的。所以,熵判據同樣可用來判定孤立系中化學過程進行的方向。
其次,根據熱力學第二定律知道,從某預定的初態到達預定終態的任何化學過程,如果能按可逆的方式進行則將獲得最大功。熱力學第二定律給我們提供了計算反應最大功的依據。
兩類化學反應的最大功
定溫定壓反應
在定溫定壓化學反應過程中,其最大有用功為:
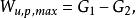 反應最大功
反應最大功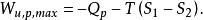 反應最大功
反應最大功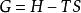 反應最大功
反應最大功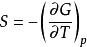 反應最大功
反應最大功上式說明定溫定壓過程的最大有用功等於系統在反應前後自由焓的變化。利用反應的熱效應也可將最大有用功寫成: 又因吉布斯函式G被定義為: ,而 ,因此吉布斯函式也可寫作為:
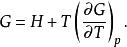 反應最大功
反應最大功對於定溫定壓的初始狀態可分別寫為:
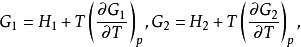 反應最大功
反應最大功則有:
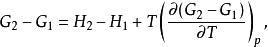 反應最大功
反應最大功即:
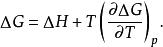 反應最大功
反應最大功若用最大功及熱效應表示,則有:
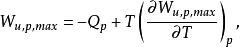 反應最大功
反應最大功上式表明了最大功隨著溫度的變化。
定溫定容反應
在定溫定容化學反應過程中,其最大有用功為:
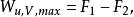 反應最大功
反應最大功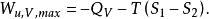 反應最大功
反應最大功上式說明定溫定容過程的最大有用功等於系統在反應前後自由能的變化。利用反應的熱效應也可將最大有用功寫成: 與定溫定壓類似的,可得,對於定溫定容反應有:
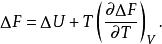 反應最大功
反應最大功若用最大功及熱效應表示,則有:
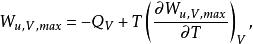 反應最大功
反應最大功上式表明了最大功隨著溫度的變化。
概括形式
定溫定容化學反應過程和定溫定壓化學反應過程的最大有用功可以寫成概括性公式,為:
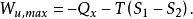 反應最大功
反應最大功若用最大功及熱效應表示,則有:
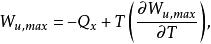 反應最大功
反應最大功上式表明了最大功隨著溫度的變化,它是化工熱力學中一個很重要的關係式,例如,在研究燃料電池時,利用它可得到燃料電池的最大有用功。
標準生成自由焓
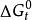 反應最大功
反應最大功不論是判斷過程進行的方向,還是計算反應的最大功,常常需要計算反應過程中自由能或自由焓的變化量。由於過程大多在定溫-定壓下進行,所以自由焓變化量的計算顯得特別重要。為了計算△G,與標準生成焓類似,規定1 atm、25℃時由穩定單質或元素生成1 mol化合物時自由焓的變化為該化合物的標準生成自由焓(或標準生成吉布斯函式),用表示。
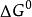 反應最大功
反應最大功這時,對於在1 atm、25℃下進行的任何反應,其自由焓變化量可利用反應物和生成物的標準生成自由焓計算,如下:
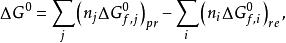 反應最大功
反應最大功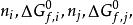 反應最大功
反應最大功其中分別為第i種反應物及第j種生成物的摩爾數及標準生成自由焓。

