簡介
病名
原發性纖維蛋白溶解症(簡稱原纖)是指由於某些原因,纖溶酶原被激活為纖溶酶,或纖溶酶抑制物減少,引起高纖溶酶血症,繼後降解纖維蛋白原,水介其他血漿凝血因子,造成以低纖維蛋白原血症為主的低凝狀態。臨床表現為各種部位的嚴重出血。
病因
 原發性纖維蛋白溶解症
原發性纖維蛋白溶解症 1、纖溶酶原激活物增多肺、胰腺、前列腺、甲狀腺及子宮等組織含有較豐富的纖溶酶原激活物。當這些器官發生腫瘤或手術時,組織纖溶酶原激活物大量釋放進入血液循環,即可引起原纖。羊水可誘發較強纖溶活動,故羊水栓塞及胎盤早期剝離時,羊水進入母體,亦可引起原纖。在嚴重缺氧、中暑及休克時,血管內皮細胞受損,其所含纖溶酶原激活物釋放入血循環,同樣會促發原纖。據統計在接受體外循環的患者中有75%~85%發生原纖。機理不清,可能由於凝血系統和纖溶系統的酶類與體外循環器材或異常血管表面接觸,而激活了纖溶系統。此外,在溶栓治療中,鏈激酶與尿激酶過量時,可導致纖溶酶大量形成,引起原纖。
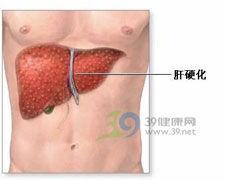
2、纖溶抑制物減少及纖溶酶原激活物滅活能力下降肝臟是纖溶抑制物α2抗纖溶酶(α2AP或α2PI)的合成場所,亦是纖溶酶原激活物滅活場所。當肝實質細胞嚴重受損時,如肝硬化、重症肝炎、在肝移植無肝期以及在肝移植後功能尚未恢復以前,纖溶抑制物產生減少,纖溶酶激活劑滅活功能降低,導致纖溶酶原激活物增多,從而激發原纖。低溫麻醉時,血漿中纖溶酶抑制物的活力降低,也有利原纖的發生。
3、先天性纖溶酶原活化物增多,尚無先天性u-PA水平升高的報導。先天性t-PA水平增高罕見,遺傳類型尚不清楚。
 原發性纖維蛋白溶解症
原發性纖維蛋白溶解症 4、嚴重肝臟疾病是原發性纖溶最常見的原因。嚴重肝臟疾病,尤其是發展到肝硬化時一些與纖溶有關的蛋白如纖溶酶原、α2AP的水平可明顯降低可能是蛋白合成功能受損所致另外正常情況下肝臟可清除t-PA、u-PA和t-PA-PAI-1複合物。肝硬化時,由於清除功能受損,導致血漿t-PA、u-PA水平升高,PAI-1水平降低。這可部分解釋為什麼肝硬化時纖溶酶原降低卻可出現纖溶增強。
5、腫瘤腺癌(尤其是前列腺癌、胰腺癌)、急性早幼粒細胞白血病(APL)等腫瘤細胞可釋放纖溶酶原活化物,其中以u-PA為常見。腫瘤細胞的這種自發性纖溶活性可促發原發性纖溶產生大量的纖溶酶,消耗α2AP循環中可測出纖溶酶α2AP複合物。
6、手術和創傷 前列腺、胰腺、子宮、卵巢、胎盤、肺、甲狀腺等組織中含較豐富的t-PA,當這些器官發生腫瘤創傷或進行手術時,因t-PA釋入血液而誘發纖溶。泌尿生殖道的創傷和手術可因u-PA釋入血液而引起纖溶。有些毒蛇的毒液具有直接激活纖溶的作用,或具有蛋白水解酶活性,通過降解纖維蛋白原和降低α2AP水平改變纖溶系統活性。當受其咬傷後可迅速出現嚴重的出血表現。
7、溶栓治療若t-PA尿激酶或鏈激酶過量可致出血併發症,這是由於超量產生的纖溶酶降解循環中的纖維蛋白原引起原發性纖溶。
8、其他羊水中有較強的促凝和促纖溶活性,羊水栓塞時可出現以纖溶增強為主要原因的出血。有文獻稱體外循環可誘發原發性纖溶其機制不詳,可能是體外循環器材、異常血管表面以及加速的血流使纖溶系統激活。各種原因所致低血壓及休克時,血流淤滯和組織缺氧等情況可促使內皮細胞釋放t-PA,也是導致纖溶的可能原因。
症狀
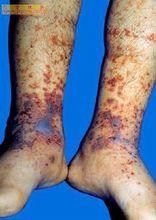
原纖臨床表現基本上與繼發者相似,有皮膚、黏膜出血,也可有消化道、泌尿道等處出血,有黑糞與血尿。急性型一般出血嚴重,常呈片狀瘀斑。若發生在注射及手術過程中,則可見針眼處及手術野滲血不止。術後創口癒合不佳。此外,失血嚴重時可引起休克。
慢性型出血程度輕,但較持久。可表現為皮膚瘀斑,黏膜出血如鼻衄、齒齦出血等。但消化道出血及血尿等症狀也不少見。失血過久可引起貧血,有時可較嚴重。
 原發性纖維蛋白溶解症
原發性纖維蛋白溶解症 血漿纖維蛋白原定量明顯減少。凝血時間、部分凝血活酶時間、凝血酶原時間以及凝血酶時間延長。這是由於原纖時所形成的纖溶酶,主要降解纖維蛋白原,還可水解因子V、Ⅷ、XⅢ等,使這些凝血因子減少導致凝血障礙。
優球蛋白溶解時間明顯縮短。血漿纖溶酶原減少,纖溶酶常增高。纖溶酶抑制物可減少。由於原纖時血漿中凝血酶、纖維蛋白單體及纖維蛋白降解產物不增高,而纖維蛋白原降解產物增多。導致3P及乙醇膠試驗陰性。
血小板計數正常、出血時間正常、紅細胞形態正常,血塗片無紅細胞碎片、無芒刺狀、盔形等畸形紅細胞。血漿抗凝血酶Ⅲ(ATⅢ)正常。根據病因、臨床表現及實驗室檢查結果,可作原纖診斷。原纖與繼發性纖溶(DIC)主要鑑別點:①3P、乙醇膠試驗:原纖為陰性,DIC為陽性;②血漿抗凝血酶Ⅲ濃度:原纖並不降低,DIC則降低;③血小板計數:原纖正常,DIC則減少;④出血時間:原纖正常,DIC延長。由於原纖與繼發性纖溶(DIC)均以出血為主要表現,因而兩者鑑別具有重要意義,但鑑別有時比較困難。兩者病因有時相同;臨床出血症狀又相似;上述各種實驗室檢查的結果,有時不夠明顯,特異性不強;故必須根據原發病,臨床表現及各種實驗室結果全面分析。
治療
 原發性纖維蛋白溶解症
原發性纖維蛋白溶解症 防治原纖的重要措施是治療促發原纖的疾病。例如外科手術過程中儘可能避免擠捏組織,減少組織損傷,這是防止原纖的重要措施。臨床應對本病高度警惕,一旦發生,及時作好與DIC的鑑別診斷,及時治療,這對防止發生嚴重後果很重要。原纖診斷一旦明確,應立即套用纖溶抑制劑。(一)6-氨基己酸(EACA)首次靜脈注射4~6g,以後每小時1g,靜脈滴注。口服每次2g,每日3~4次,視病情可連續服用7~10天。
(二)對羧基苄胺(抗血纖溶芳酸、PAMBA)靜注或靜滴,每日400~800mg。口服,成人每次400~600mg,每日最大劑量為2克。
(三)止血環酸(凝血酸、AMCA)靜注或靜滴,每次250~500mg,每日1~2次,日劑量可達1~2g。
此外,還須輸入纖維蛋白原或血漿,以糾正低纖維蛋白原血症及補充其他凝血因子,使血漿纖維蛋白原濃度恢復至2g/L(200mg%)以上。原纖時應先用纖維蛋白溶解抑制劑,然後輸入纖維蛋白原或血漿,或同時使用。單用纖維蛋白原或血漿,而不注射纖溶抑制劑,並不能奏效,有時反而使出血惡化。
發病機制
由於失去了α2AP的抑制作用,體內纖溶酶活性異常增高,止血血栓過早溶解導致出血傾向。一旦出血,往往較重多是外傷或手術後數小時出血自發出血罕見。雜合子患者大多無症狀或僅有輕度出血。也有α2AP分子異常的報導即血漿中α2AP的抗原水平正常,但其抑制纖溶酶的活性明顯降低。分子生物學研究表明此乃基因突變使得距α2AP活性中心N末端10個胺基酸殘基處插入了1個丙氨酸,使α2AP不再具有抗纖溶酶活性。相反成為纖溶酶的底物,臨床表現為易出現皮膚青紫及術後出血延長等。 血中纖溶酶原活化物明顯升高,此種活化物在生理上和免疫上均與t-PA相似。雖然血中未測到游離的纖溶酶,但血中總能測出纖溶酶-α2AP複合物。血漿中PAI-1抗原水平正常但限於當時的技術未測PAI-1活性。患者的循環血中持續有纖維蛋白或纖維蛋白原溶解的表現,其全血凝塊在6h內溶解。纖維蛋白原水平降低,纖維蛋白原相關抗原水平持續明顯升高。異常升高時可因纖溶酶的大量形成,造成纖維蛋白過早溶解和纖維蛋白原的降解而引起出血。
大多學者認為APL出血主要是DIC及繼發性纖溶所致。但也有作者的研究表明雖然APL患者出血很重,但沒有凝血酶形成和纖維蛋白原等凝血因子大量消耗的確切證據,故他們認為雖然白血病細胞能釋放出具有促凝活性的物質,但血管內凝血並不嚴重。所以纖維蛋白原等凝血因子的消耗,不至於成為出血的直接原因。相反患者均有明顯的全身性纖溶的實驗室證據。另外,與DIC繼發纖溶不同的是,APL患者的纖溶酶形成大多與u-PA有關,而前者大多是由於內皮細胞損傷大量t-PA釋放入血所致。APL的早幼粒細胞除了釋放u-PA還可釋放能滅活α2AP的白細胞彈力蛋白酶。
輔助檢查
血漿纖維蛋白原定量明顯減少。凝血時間、部分凝血活酶時間、凝血酶原時間以及凝血酶時間延長。這是由於原纖時所形成的纖溶酶,主要降解纖維蛋白原,還可水解因子V、Ⅷ、XⅢ等,使這些凝血因子減少導致凝血障礙。
優球蛋白溶解時間明顯縮短。血漿纖溶酶原減少,纖溶酶常增高。纖溶酶抑制物可減少。由於原纖時血漿中凝血酶、纖維蛋白單體及纖維蛋白降解產物不增高,而纖維蛋白原降解產物增多。導致3P及乙醇膠試驗陰性。
血小板計數正常、出血時間正常、紅細胞形態正常,血塗片無紅細胞碎片、無芒刺狀、盔形等畸形紅細胞。血漿抗凝血酶Ⅲ(ATⅢ)正常。
診斷
根據病因、臨床表現及實驗室檢查結果,可作原纖診斷。原纖與繼發性纖溶(DIC)主要鑑別點:①3P、乙醇膠試驗:原纖為陰性,DIC為陽性;②血漿抗凝血酶Ⅲ濃度:原纖並不降低,DIC則降低;③血小板計數:原纖正常,DIC則減少;④出血時間:原纖正常,DIC延長。 由於原纖與繼發性纖溶(DIC)均以出血為主要表現,因而兩者鑑別具有重要意義,但鑑別有時比較困難。兩者病因有時相同;臨床出血症狀又相似;上述各種實驗室檢查的結果,有時不夠明顯,特異性不強;故必須根據原發病,臨床表現及各種實驗室結果全面分析。