概念提出
 原子經濟性
原子經濟性體現
原子經濟反應是原子經濟性的現實體現。理想的原子經濟性的反應應該是原料分子中的原子百分之百地轉變成產物,不需要附加,或僅僅需要無損耗的促進劑,即催化劑,達到零排放(zeroemission)。如:A+B=C
原子經濟反應是最大限度利用資源、最大限度減少污染的必要條件,但不是充分條件。這是因為某些化學反應中:
1,反應平衡轉化率很低,反應物與產物分離困難,反應物難於循環使用;
2,生產目標產物的反應是原子經濟的,但反應物還能同時發生其他平行反應,生產不需要的副產物。
反應的原子經濟性、高轉化率、高選擇性是實現資源合理利用、避免污染缺一不可的。
化學反應的“原子經濟性”則是指在化學反應中究竟有多少原料的原子進入到產品之中。我們常用原子利用率來衡量化學過程的原子經濟性。在合成反應中,要減少廢物排放的關鍵是提高目標產物的選擇性和原子利用率,即化學反應中,到底有多少反應物的原子轉變到了目標產物中。
原子利用率的定義是目標產物的占反應物總量的百分比。即原子利用率=(預期產物的分子量/全部生成物的分子量總和)×100%
用原子利用率可以衡量在一個化學反應中,生產一定量目標產物到底會生成多少廢物。在化學反應中,一旦要利用的化學反應計量式被確定下來,則其最大原子利用率也就確定了。
一般狀況下,有機反應中的重排反應和加成反應以及無機反應中的化合反應的原子經濟性最高,為100%。其他類型反應院子經濟性則較低。
原子利用率達到100%的反應有兩個最大的特點:
1,最大限度地利用了反應原料,最大限度地節約了資源;
2,最大限度地減少了廢物排放(“零廢物排放”),因而最大限度地減少了環境污染,或者說從源頭上消除了由化學反應副產物引起的污染。
開發“原子經濟性”反應
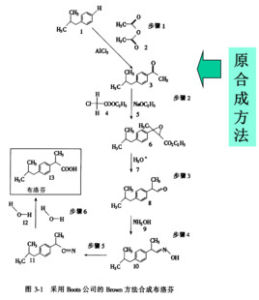
開發原子經濟性反應已成為綠色化學研究的熱點之一。例如,環氧丙烷是生產聚氨酯塑膠的重要原料,傳統上主要採用二步反應的氯醇法,不僅使用可能帶來危險的氯氣,而且還產生大量污染環境的含氯化鈣廢水,國內外均在開發催化氧化丙烯制環氧丙烷的原子經濟反應新方法。再如,EniChem公司採用鈦矽分子篩催化劑,將環己酮、氨、過氧化氫反應,可直接合成環己酮肟。對於已在工業上套用的原子經濟反應,也還需要從環境保護和技術經濟等方面繼續研究和改進。實現反應的高原子經濟性,就要通過開發新的反應途徑、用催化反應代替化學計量反應等手段,1997年的新合成路線獎的獲得者BCH公司的工作即是一個很好的例證。該公司開發了一種合成布洛芬的新工藝(布洛芬是一種廣泛使用的非類固醇類的鎮靜、止痛藥物),傳統生產工藝包括6步化學計量反應,原子的有效利用率低於40%,新工藝採用3步催化反應,原子的有效利用率達80%,如果再考慮副產物乙酸的回收利用,則原子利用率達到99%。